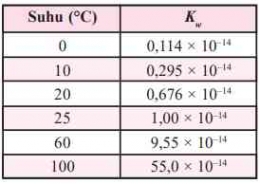
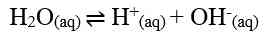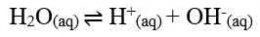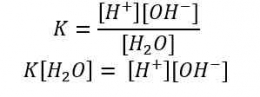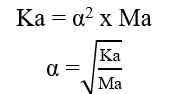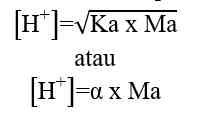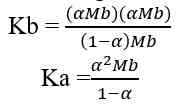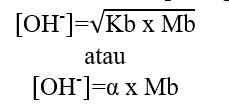Jika nilai α sangat kecil (α << 1), maka dapat diasumsikan nilai (1- α) = 1, sehingga persamaan Kb untuk asam lemah adalah sebagai berikut.
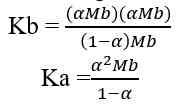
Sehingga, untuk menghitung konsentrasi ion H+ dapat digunakan nilai Ka ataupun nilai α
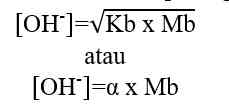
Keterangan:
Kb = tetapan ionisasi basa lemah
Mb = molaritas basa lemah
α = derajat ionisasi basa lemah
Derajat Keasaman (pH)
- Konsep pH
Berdasarkan tetapan kesetimbangan air dapat disimpulkan bahwa besarnya [H+] dalam suatu larutan merupakan salah satu ukuran untuk menentukan tingkat keasaman suatu larutan. Untuk menyatakan tingkat atau derajat keasaman suatu larutan diperkenalkan suatu bilangan sederhana oleh Soren Lautiz Sorensen yang diperoleh dari hasil logaritma konsentrasi H+. Bilangan ini dikenal dengan skala pH. Harga pH berkisar 1-14 yang dirumuskan sebagai berikut.
pH = - log [H+]