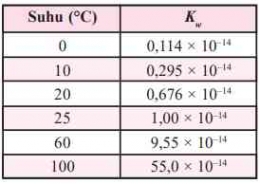
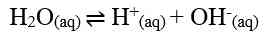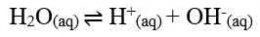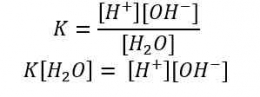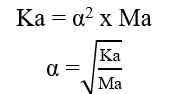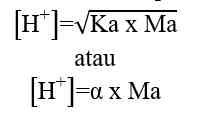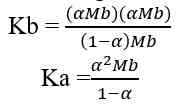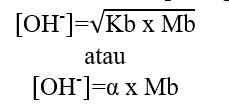Oleh karena [H+] [OH-] = 10^-14, maka [H+] = 10^-7 dan [OH-] = 10^-7, artinya dalam 1 liter air murni terkandung ion H+ dan ion OH- masing-masing sebanyak 10^-7. Jika terjadi penambahan asam, maka [H+] akan bertambah namun hasil perkalian [H+] [OH-] tetap sama dengan Kw. Hal ini disebabkan oleh pergeseran kesetimbangan ke arah kiri yang menyebabkan pengurangan [OH-]. Pergeseran kesetimbangan juga berlaku pada penambahan basa.
Pengaruh Asam dan Basa Terhadap Sistem Kesetimbangan Air
Pengaruh Asam
Menurut konsep pergeseran kesetimbangan, pengaruh penambahan asam pada air murni, menyebabkan perbandingan ion H+ dan OH- menjadi [H+] > [OH-].
Pengaruh Basa
Menurut konsep pergeseran kesetimbangan, pengaruh penambahan basa pada air murni, menyebabkan perbandingan ion H+ dan OH- menjadi [H+] < [OH-].
Perhitungan Konsentrasi Ion H+ dan OH- dalam Larutan
Berdasarkan sistem kesetimbangan air, kekuatan asam sebanding dengan jumlah ion H+, sedangkan kekuatan basa sebanding dengan jumlah ion OH-. Berikut cara menentukan besarnya konsentrasi ion H+ dan ion OH- dalam larutan asam dan basa.
- Asam Kuat
Asam kuat dapat terionisasi secara sempurna dalam air. Dalam larutan asam, jumlah ion H+ lebih banyak dibandingkan ion OH-.
Rumus perhitungan konsentrasi ion H+ dalam larutan asam.