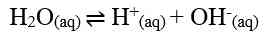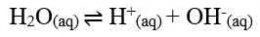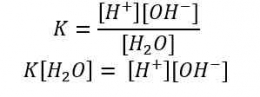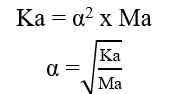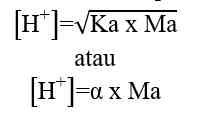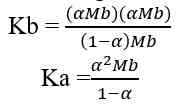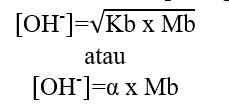Dalam kehidupan sehari-hari banyak dijumpai senyawa asam dan basa. Buah-buahan memiliki rasa asam karena terdapat kandungan asam di dalamnya. Misalnya, jeruk yang memiliki kandungan asam sitrat, cuka yang mengandung asam asetat, dan kulit pohon yang mengandung asam tanak.
Demikian juga basa yang dalam kehidupan sehari-hari digunakan sebagai pembersih lantai, sabun, dan pasta gigi. Larutan asam dan basa merupakan larutan elektrolit yang penting dan banyak digunakan dalam reaksi kimia.
Konsep Asam Basa Menurut Beberapa Ahli
Istilah asam (acid) berasal dari bahasa Latin yaitu acetum yang berarti cuka, sedangkan istilah basa (alkali) berasal dari bahasa Arab yang berarti abu. Adapun teori asam basa menurut beberapa ahli adalah sebagai berikut.
1. Teori Asam Basa Arrhenius
Teori asam basa Arrhenius menjelaskan bahwa asam merupakan senyawa yang jika dilarutkan dalam air dapat melepaskan ion OH+, sedangkan basa merupakan senyawa yang jika dilarutkan dalam air dapat menghasilkan ion OH-. Dengan demikian, teori ini hanya terbatas untuk larutan dengan pelarut air. Senyawa asam dan basa jika dilarutkan dalam air akan mengalami reaksi ionisasi.
2. Teori Asam Basa Bronsted Lowry
Teori asam basa bronsted lowry menjelaskan bahwa asam merupakan spesi yang memberikan proton atau donor proton (H+), sedangkan basa merupakan spesi yang menerima proton atau akseptor proton (OH-). Berbeda dengan teori asam basa Arrhenius, teori ini dapat menjelaskan sifat asam dan basa suatu larutan tanpa menggunakan pelarut air.
3. Teori Asam Basa Lewis
Teori asam basa lewis menjelaskan bahwa asam merupakan spesi yang menerima pasangan elektron, sedangkan basa merupakan spesi yang memberikan pasangan elektron.
Contoh: Reaksi asam-basa antara BF3 sebagai asam lewis dan NH3 sebagai basa lewis. Dalam reaksi ini, NH3 memberikan pasangan elektron kepada BF3 sehingga membentuk ikatan kovalen koordinasi antara keduanya.
Kesetimbangan Ion dalam Larutan Asam dan Basa
- Tetapan Kesetimbangan Air (Kw)
Air murni merupakan larutan elektrolit lemah. Artinya, hanya sebagian kecil molekul-molekul air dapat terionisasi menjadi ion H+ dan ion OH- menurut reaksi:
Melalui reaksi tersebut, tetapan kesetimbangan air dapat dirumuskan sebagai berikut.
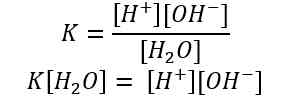
Fraksi molekul air yang terionisasi sangat kecil, sehingga konsentrasi air hampir tidak berubah. Dengan demikian:
K [H2O] = Kw = [H+] [OH-]
Kw = [H+] [OH-]
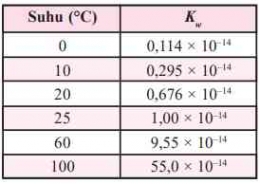
Pada suhu 25C, Kw yang diperoleh dari percobaan adalah 1,0 x 10^-14. Harga Kw tergantung pada suhu, tetapi harga Kw dianggap tetap untuk percobaan yang suhunya tidak terlalu menyimpang jauh dari 25C.
Kw = [H+] [OH-] = 10^-14
Berikut merupakan harga Kw pada berbagai suhu.

Oleh karena [H+] [OH-] = 10^-14, maka [H+] = 10^-7 dan [OH-] = 10^-7, artinya dalam 1 liter air murni terkandung ion H+ dan ion OH- masing-masing sebanyak 10^-7. Jika terjadi penambahan asam, maka [H+] akan bertambah namun hasil perkalian [H+] [OH-] tetap sama dengan Kw. Hal ini disebabkan oleh pergeseran kesetimbangan ke arah kiri yang menyebabkan pengurangan [OH-]. Pergeseran kesetimbangan juga berlaku pada penambahan basa.
Pengaruh Asam dan Basa Terhadap Sistem Kesetimbangan Air
Pengaruh Asam
Menurut konsep pergeseran kesetimbangan, pengaruh penambahan asam pada air murni, menyebabkan perbandingan ion H+ dan OH- menjadi [H+] > [OH-].
Pengaruh Basa
Menurut konsep pergeseran kesetimbangan, pengaruh penambahan basa pada air murni, menyebabkan perbandingan ion H+ dan OH- menjadi [H+] < [OH-].
Perhitungan Konsentrasi Ion H+ dan OH- dalam Larutan
Berdasarkan sistem kesetimbangan air, kekuatan asam sebanding dengan jumlah ion H+, sedangkan kekuatan basa sebanding dengan jumlah ion OH-. Berikut cara menentukan besarnya konsentrasi ion H+ dan ion OH- dalam larutan asam dan basa.
- Asam Kuat
Asam kuat dapat terionisasi secara sempurna dalam air. Dalam larutan asam, jumlah ion H+ lebih banyak dibandingkan ion OH-.
Rumus perhitungan konsentrasi ion H+ dalam larutan asam.
H+] = Ma x a
Keterangan:
[H+] = konsentrasi ion H+ (mol/L atau M)
Ma = molaritas asam kuat (mol/L atau M)
a = valensi asam kuat
- Basa Kuat
Basa kuat dapat terionisasi secara sempurna dalam air. Dalam larutan asam, jumlah ion OH- lebih banyak dibandingkan ion H+.
Rumus perhitungan konsentrasi ion OH- dalam larutan asam.
[OH-] = Mb x b
Keterangan:
[OH-] = konsentrasi ion OH- (mol/L atau M)
Mb = molaritas basa kuat (mol/L atau M)
b = valensi basa kuat
- Asam Lemah
Asam lemah dapat terionisasi secara sebagian dalam air. Dalam air, sebagian molekul asam lemah terurai menjadi ion-ionnya sehingga derajat ionisasinya 0 < α < 1.
Jika nilai α sangat kecil (α << 1), maka dapat diasumsikan nilai (1- α) = 1, sehingga persamaan Ka untuk asam lemah adalah sebagai berikut.
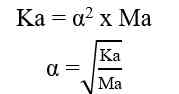
Sehingga, untuk menghitung konsentrasi ion H+ dapat digunakan nilai Ka ataupun nilai α
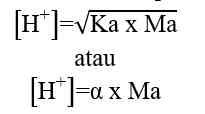
Keterangan:
Ka = tetapan ionisasi asam lemah
Ma = molaritas asam lemah
α = derajat ionisasi asam lemah
- Basa Lemah
Basa lemah dapat terionisasi secara sebagian dalam air. Dalam air, sebagian molekul asam lemah terurai menjadi ion-ionnya sehingga derajat ionisasinya 0 < α < 1.
Jika nilai α sangat kecil (α << 1), maka dapat diasumsikan nilai (1- α) = 1, sehingga persamaan Kb untuk asam lemah adalah sebagai berikut.

Sehingga, untuk menghitung konsentrasi ion H+ dapat digunakan nilai Ka ataupun nilai α

Keterangan:
Kb = tetapan ionisasi basa lemah
Mb = molaritas basa lemah
α = derajat ionisasi basa lemah
Derajat Keasaman (pH)
- Konsep pH
Berdasarkan tetapan kesetimbangan air dapat disimpulkan bahwa besarnya [H+] dalam suatu larutan merupakan salah satu ukuran untuk menentukan tingkat keasaman suatu larutan. Untuk menyatakan tingkat atau derajat keasaman suatu larutan diperkenalkan suatu bilangan sederhana oleh Soren Lautiz Sorensen yang diperoleh dari hasil logaritma konsentrasi H+. Bilangan ini dikenal dengan skala pH. Harga pH berkisar 1-14 yang dirumuskan sebagai berikut.
pH = - log [H+]
Analog dengan di atas maka:
pOH = - log [OH-]
Hubungan antara pH dan pOH adalah sebagai berikut.
Kw = [H+] [OH-]
-log Kw = -log [H+] + (-log [OH-])
Dengan demikian:
pKw = pH + pOH
Pada suhu 25oC, pKw = pH + pOH = 14
Berdasarkan uraian di atas dapat disimpulkan bahwa sifat larutan adalah sebagai berikut.
- Netral jika [H+] = [OH-] atau pH = pOH = 7
- Asam jika [H+] > [OH-] atau pH < 7
- Basa jika [H+] < [OH-] atau pH >7
Indikator asam basa
Indikator asam basa merupakan senyawa khusus yang ditambahkan pada larutan dengan tujuan mengetahui kisaran pH dari larutan tersebut. Indikator asam basa akan memberikan warna tertentu apabila direaksikan dengan larutan asam atau basa. Indikator asam basa merupakan senyawa khusus yang ditambahkan pada larutan dengan tujuan mengetahui kisaran pH dari larutan tersebut. Indikator asam basa akan memberikan warna tertentu apabila direaksikan dengan larutan asam atau basa.
1. Indikator alami
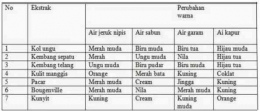
Indikator alami dapat diperoleh dari tanaman yang mempunyai warna terang. Contoh: kunyit, kol ungu, kulit manggis, bunga sepatu, pacar air, dan bunga bougenvil. Tanaman dapat dijadikan indikator alami apabila terjadi perubahan warna dari ekstrak yang diteteskan pada larutan asam basa.
Berikut merupakan tabel perubahan warna dari beberapa indikator alami.
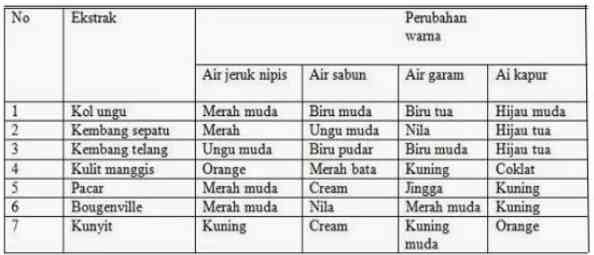
2. Indikator hasil sintesis di laboratorium
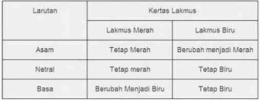
- Kertas lakmus
Sebagai indikator asam basa, kertas lakmus dapat memberikan perubahan warna biru dan merah. Berikut merupakan perubahan warna pada kertas lakmus ketika bereaksi dengan larutan asam atau basa.
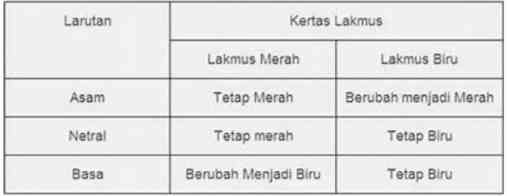
- Indikator universal
pH suatu larutan dapat ditentukan dengan menggunakan indikator universal yang merupakan campuran dari berbagai indikator yang dapat menunjukkan pH suatu larutan dari perubahan warnanya. Indikator ini memberikan warna yang berbeda untuk setiap nilai pH nya.
- Larutan indikator
Larutan indikator dapat kita jumpai dalam laboratorium. Indikator ini dapat menunjukkan perubahan warna pada rentang nilai pH tertentu.
- pH meter
pH meter merupakan alat pengukur pH yang cepat dan akurat. Alat ini dilengkapi dengan elektroda yang penggunaanya dilakukan dengan cara mencelupkan alat ke dalam larutan yang akan diukur nilai pH nya. Nilai pH dapat dilihat pada layar digital dari alat tersebut.
Follow Instagram @kompasianacom juga Tiktok @kompasiana biar nggak ketinggalan event seru komunitas dan tips dapat cuan dari Kompasiana. Baca juga cerita inspiratif langsung dari smartphone kamu dengan bergabung di WhatsApp Channel Kompasiana di SINI