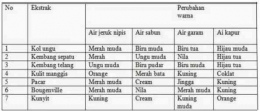
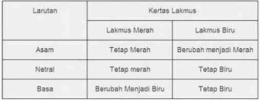
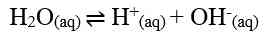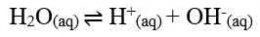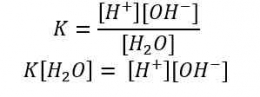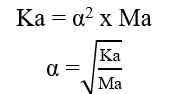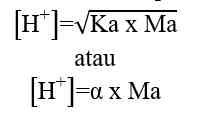Kesetimbangan Ion dalam Larutan Asam dan Basa
- Tetapan Kesetimbangan Air (Kw)
Air murni merupakan larutan elektrolit lemah. Artinya, hanya sebagian kecil molekul-molekul air dapat terionisasi menjadi ion H+ dan ion OH- menurut reaksi:

Melalui reaksi tersebut, tetapan kesetimbangan air dapat dirumuskan sebagai berikut.

Fraksi molekul air yang terionisasi sangat kecil, sehingga konsentrasi air hampir tidak berubah. Dengan demikian:
K [H2O] = Kw = [H+] [OH-]
Kw = [H+] [OH-]
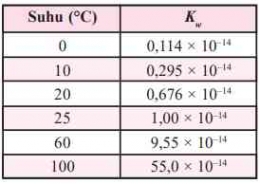
Pada suhu 25C, Kw yang diperoleh dari percobaan adalah 1,0 x 10^-14. Harga Kw tergantung pada suhu, tetapi harga Kw dianggap tetap untuk percobaan yang suhunya tidak terlalu menyimpang jauh dari 25C.
Kw = [H+] [OH-] = 10^-14
Berikut merupakan harga Kw pada berbagai suhu.