Setiap bulan Desember, tepatnya 1 Desember diperingati sebagai hari AIDS sedunia . Tahun ini mengusung tema "Akhiri ketimpangan. Akhiri AIDS, dengan pesan indah nya bahwa Peningkatan Kewaspadaan pada HIV AIDS, dimana WHO ingin memfokuskan kampanye Hari AIDS sedunia 2021 kepada semua warga negara untuk waspada pada bahaya penyakit HIV AIDS. Anjuran itu ditujukan pada negara yang kurang waspada terhadap bahaya yang menghancam akibat merebaknya HIV AIDS.
Masuk akal, bila kampanye itu disebarkan kei seluruh dunia, khususnya negara-negara yang berisiko tinggi akan penyebaran penyakit HIV AIDS, apalagi adanya COVID-19, sehingga kewaspadaan harus dibuat padu dan bersama-sama/
Banyak permasalahan yang muncul dari HIV AIDS, karena merebaknya kasus HIV/AIDS dapat berdampak pada jumlah sumber daya manusia yang terinveksi , sehingga produktivitas menurun, hal ini .dapat memunculkan beban negara yang tidak ringan
Meningkatnya kasus HIV/AIDS yang menyebar di kalangan remaja, terus meningkat Di Indonesia, hingga 2018, pengidap HIV pada anak dan remaja (di bawah 19 tahun) terus bertambah, mencapai 2.881 orang. Jumlah tersebut meningkat dari tahun 2010, yaitu sebanyak 1.622 anak terinfeksi HIV Secara umum, cara penularan enam dari sembilan kasus pada kelompok usia 15-19 tahun adalah melalui aktivitas seksual di kalangan homoseksual atau biseksual ( Kompas.com - 01/12/2020)
Oleh karena itu, pemerintah perlu memperhatikan peningkatan kasus tersebut. Berbagai upaya nampaknya perlu di lakukan oleh semua pihak dimana pemerintah sebagai inisiatornya, yaitu menerapkan survailans tes HIV melalui skrining rutin kepada perempuan hamil merupakan langkah konkret untuk mendeteksi kasus HIV pada perempuan hamil. Langkah berbeda juga perlu dilakukan pada survailans kaum laki-laki , dilakukan terhadap pasien IMS (infeksi menular seksual), jika melakukan hubungan tanpa kondom serta pada pengguna narkoba suntikan, narapidana, darah donor dan pasien TB.
Dibingkai itu, salah satu alternatif pemecahan penyebaran dan pengobatan yang menggunakan spesi lain menarik untuk disimak Meskipun kemajuan besar dalam kemampuan kita untuk mencegah dan mengobati infeksi HIV-1, HIV-1 tetap merupakan penyakit yang tidak dapat disembuhkan dan vaksin HIV-1 yang sangat manjur belum tersedia. Oleh karena itu, alat tambahan untuk mencegah dan mengobati HIV-1 sangat diperlukan. Salah satu strategi adalah dengan menggunakan Imunisasi pasif.
Imunisasi Pasif
Imunitas pasif adalah imunisasi yang terjadi saat tubuh memperoleh imunitas dengan cara menyuntikan serum pada tubuh yang didalamnya mengandung antibodi terhadap suatu penyakit. Imunisasi ini biasanya diberikan saat dalam keadaan darurat yang diperkirakan tidak ada waktu pembentukan antibodi yang cukup untuk melawan antigen yang masuk dalam tubuh. Contohnya ketika seseorang digigit ular, maka akan diberikan serum antibisa.
Oleh karena itu imunisasi pasif dengan antibodi telah digunakan selama satu abad untuk pencegahan dan pengobatan penyakit menular. Plasma kaya antibodi awalnya dievaluasi sebagai terapi terhadap infeksi HIV-1 pada awal 1990-an dengan keberhasilan yang sangat terbatas. Pada tahun-tahun berikutnya, beberapa antibodi penetralisir monoklonal generasi pertama diidentifikasi dan diuji di klinik.
Identifikasi antibodi penetralisir yang kuat dan luas (bNAbs) terhadap HIV-1 telah merevolusi bidang ini dan mungkin terbukti bermanfaat secara klinis. Kemajuan signifikan telah dibuat dalam mengidentifikasi antibodi yang lebih luas dan lebih kuat, mengkarakterisasi antibodi dalam model hewan praklinis, merekayasa antibodi untuk memperpanjang waktu paruh dan memperluas cakupan dan fungsionalitas, dan mengevaluasi kemanjuran kombinasi bNAb dan bNAb tunggal pada orang dengan dan tanpa HIV- 1. Oleh karena itu, ulasan ini, saya ingin meninjau kemajuan terbaru dalam mengembangkan bNAbs untuk pencegahan dan pengobatan HIV-1 sungguh sangat menarik untuk diulas..
Kombinasi Nabs 2G12, 2F5, 4E10 hanya mengendalikan viremia sedang selama penghentian pengobatan antiretroviral (ART) dan mengakibatkan munculnya varian yang resistan terhadap antibodi. Pengenalan antibodi penetralisir luas generasi kedua (bNAbs) dengan potensi dan keluasan yang ditingkatkan secara signifikan baru-baru ini memicu antusiasme baru untuk prospek pengembangan terapi antibodi monoklonal yang berguna secara klinis untuk HIV-1. Memang, selama dekade terakhir kemajuan substansial dalam mengkarakterisasi bNAb ini in vitro serta in vivo dalam model praklinis telah dibuat, dan pengembangan klinis untuk beberapa bNAb sedang berlangsung.
Perlu diketahui bahwa, temuan terbaru: Transfer pasif bNAbs generasi kedua menghasilkan perlindungan yang tidak efektif terhadap infeksi pada model hewan praklinis. Lebih lanjut, beberapa bNAb yang menargetkan epitop yang berbeda pada trimer amplop HIV-1 sedang dalam evaluasi klinis dan telah menunjukkan profil keamanan yang menguntungkan dan aktivitas antivirus yang kuat pada individu yang terinfeksi secara kronis. Konfirmasi bahwa imunisasi pasif dengan bNAb(s) akan mencegah akuisisi HIV-1 pada manusia tertunda dan fokus penyelidikan yang sedang berlangsung. Mengingat keragaman global HIV-1, kombinasi bNAb atau antibodi multispesifik kemungkinan besar akan diperlukan untuk menghasilkan keluasan yang diperlukan untuk perlindungan yang efektif.
Hasil yang menggembirakan dari studi praklinis dan klinis mendukung pengembangan bNAb untuk pencegahan dan sejumlah antibodi dengan luas dan potensi luar biasa tersedia untuk evaluasi klinis. Optimalisasi lebih lanjut dari cakupan virus dan waktu paruh antibodi akan mempercepat implementasi klinis bNAbs sebagai alat penting untuk strategi pencegahan HIV-1.
PERJALAN VAKSI HIV
Meskipun upaya penelitian yang signifikan selama lebih dari tiga dekade, vaksin pelindung terhadap HIV-1 telah sulit dipahami. Oleh karena itu, pendekatan alternatif untuk pencegahan HIV-1 diperlukan sampai strategi vaksin yang berhasil ditemukan. Gagasan pemberian antibodi penetralisir pasif telah dikemukakan sejak awal, namun kurangnya kemanjuran menggunakan antibodi penetral generasi pertama (nAb) dengan potensi terbatas dan luasnya mengurangi antusiasme untuk pendekatan ini.
Dengan diperkenalkannya uji netralisasi keluaran tinggi yang dapat direproduksi dalam kombinasi dengan pengurutan reseptor sel B tunggal menggunakan probe amplop HIV-1 untuk menyortir sel B spesifik HIV-1 , generasi baru antibodi penetralisir yang sangat kuat dan luas (bNAbs) telah diidentifikasi. Sosok bNAb generasi baru ini hingga 100 kali lipat lebih kuat daripada antibodi generasi pertama dan menunjukkan keluasan netralisasi yang signifikan terhadap strain HIV-1.
Beberapa antibodi terhadap berbagai situs kerentanan pada trimer amplop HIV-1 telah dijelaskan menargetkan situs pengikatan CD4 gp120, situs V2-glikan di puncak trimer Env, situs V3-glikan, situs eksternal membran-proksimal. region (MPER) dari gp41, dan baru-baru ini region antarmuka antara gp120 dan gp41.
Dalam tinjauan berikut, akan membahas kemajuan yang telah dicapai dalam mengevaluasi peran potensial antibodi penetralisir dalam mencegah infeksi HIV-1 dan kami saya akan menyoroti hambatan dan jalan potensial di masa yang akan datang untuk pengembangan bNAb.
BUKTI PERLINDUNGAN ANTIBODI PADA HEWAN MODEL
Primata non-manusia (Non-human primates , NHP),. khususnya kera rhesus bayi dan dewasa, telah digunakan untuk memodelkan penularan HIV-1 alami oleh hewan yang berhadapan mukosa dengan chimeric simian-human immunodeficiency virus (SHIV) yang mengekspresikan amplop HIV-1 pada tulang punggung SIV.
Model ini memungkinkan untuk mengukur kemanjuran perlindungan imunoglobulin yang diberikan secara pasif dengan menantang hewan baik dengan SHIV dosis tinggi tunggal atau tantangan dosis rendah berulang setelah pemberian antibodi. Studi yang menggunakan model ini sejauh ini menunjukkan berbagai tingkat perlindungan, sebagian besar dipengaruhi oleh sensitivitas netralisasi dari stok tantangan terhadap antibodi yang diberikan ..
Penelitian Moldt dkk menunjukkan bahwa antibodi glikan V3 PGT121 sepenuhnya melindungi kera terhadap tantangan dosis tinggi dengan tingkat 2 SHIV-SF162P3 pada dosis 5 mg/kg dan 1 mg/kg pada konsentrasi serum antibodi 95 g/mL, dan 15 g /mL (23). BNAb kuat lainnya termasuk VRC01, VRC07--523, 3BNC117 dan 10--1074 juga telah menunjukkan perlindungan . dan PGDM1400 dan CAP256-VRC26.25 hewan yang dilindungi terhadap tantangan clade C SHIV-325c pada dosis 0,4 (PGDM1400) dan bahkan 0,08 mg/kg (CAP256-VRC26.25) dengan konsentrasi serum serendah 0,75 g/mL .
Ketika membandingkan kombinasi bNAb/SHIV yang berbeda dalam model tantangan NHP, disarankan bahwa titer netralisasi plasma 1:100 diperlukan untuk mencegah infeksi virus pada 50% monyet yang terpapar . Keterbatasan model untuk menguji bNAb manusia adalah ketergantungan pada galur SHIV yang sensitif terhadap bNAb yang digunakan saat ini dan ketersediaannya yang terbatas, kurangnya kawanan SHIV untuk meniru keragaman HIV-1, dan virulensi yang relatif rendah dari beberapa SHIV. strain yang digunakan. Generasi baru galur SHIV, yang memiliki lebih banyak kesamaan dengan HIV-1 dan mewakili amplop non-clade B telah dan sedang dikembangkan dan diharapkan akan memperluas armamentarium untuk menilai bNAbs dalam studi transfer pasif .
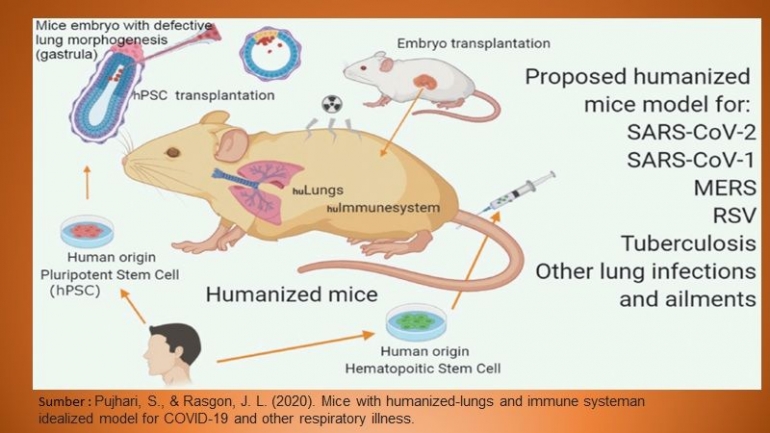
Tikus Manusiawi (Humanized mice)
Mengingat tingginya biaya yang terkait dengan penelitian NHP dan kendala penggunaan virus simian immunodeficiency, model tikus yang dimanusiakan mulai dipekerjakan untuk mempelajari penularan HIV-1.
Kehadiran sel hematopoietik dan limfoid manusia pada hewan ini mendukung infeksi HIV-1 dan memungkinkan pengujian bNAbs in-vivo terhadap HIV-1. Beberapa penelitian sebelumnya untuk menunjukkan kemanjuran perlindungan nAbs dan telah dilakukan pada tikus manusia dan perlindungan oleh banyak bNAb generasi baru dinilai dalam model ini.
Pemulihan kekebalan yang tidak lengkap, mis. pembentukan terbatas jaringan limfoid sekunder dan penurunan tingkat dan fungsi sel efektor bawaan seperti sel NK namun telah membatasi penerapan model ini. Secara khusus kemampuan untuk menentukan fungsionalitas antivirus yang dimediasi Fc tergantung pada ketersediaan yang cukup dari sel efektor pengekspresi reseptor Fc bawaan.
KEANEKARAGAMAN VIRUS
Berbeda dengan model NHP virus . tunggal, manusia selama penularan HIV-1 alami terpapar pada kawanan virus dan salah satu tantangan utama untuk strategi pencegahan berbasis bNAb adalah keragaman virus yang luas yang diamati pada galur HIV-1 yang bersirkulasi. Idealnya, bNAb yang digunakan untuk pencegahan akan mencakup 100% strain yang bersirkulasi namun bahkan bNAb yang paling luas pun tidak mampu menetralisir semua strain HIV-1 secara potensial. Wagh dkk. baru-baru ini menentukan luas dan kemanjuran netralisasi kombinasi antibodi terhadap panel 200 isolat clade C . dan data menunjukkan bahwa setidaknya tiga bNAb akan diperlukan untuk mencegah dan mengobati infeksi HIV-1.
Memang, kombinasi PGT121 dan PGDM1400 diperlukan untuk melindungi kera terhadap tantangan SHIV campuran yang konsisten dengan SHIV SF162P3, sensitif terhadap PGT121 tetapi tidak PGDM1400, dan SHIV 325c dengan pola sensitivitas yang berlawanan, sedangkan pemberian masing-masing antibodi saja menghasilkan 100% terobosan infeksi dengan masing-masing strain SHIV resisten .
Oleh karena itu, upaya untuk meningkatkan cakupan virus sedang berlangsung yang mencakup pengembangan antibodi bispesifik yang menargetkan Env dan reseptor atau koreseptor HIV-1 dan baru-baru ini Huang menggabungkan antibodi MPER 10E8 dengan iMab, N-terminus rantai berat dari ibalizumab. 10E8/iMab mencakup 100% dari panel 118-virus dengan nilai IC50 rata-rata 0,002 g/mL dan melindungi tikus dari HIV-1JR-CSF challenge. Menggabungkan 3 kekhususan epitop Env yang berbeda, antibodi trispesifik VRC01/PGDM1400--10E8v4 menunjukkan luas dan potensi yang sangat baik dan memberikan kekebalan lengkap terhadap campuran SHIV pada primata bukan manusia, berbeda dengan bNAb tunggal. Kombinasi dua atau lebih bNAb, atau antibodi yang direkayasa dengan beberapa kekhususan Fab yang menargetkan beberapa epitop HIV-1 Env, oleh karena itu kemungkinan besar diperlukan untuk secara potensial mencakup keseluruhan keragaman HIV-1 .
BAGAIMANAKAH STATUS STUDI bNAbs SAAT INI PADA MANUSIA?
Selama beberapa tahun terakhir, ada serangkaian penelitian yang mengevaluasi bNAbs baru termasuk VRC01, 3BNC117, dan 10-1074 untuk keamanan dan tolerabilitas pada orang yang tidak terinfeksi HIV dan juga menilai kemanjuran antivirus pada orang yang hidup dengan HIV. Studi dengan antibodi PGT121, PGDM1400, VRC07--523LS dan N6LS sedang berlangsung (NCT02960581, NCT03015181, NCT03205917, NCT03538626, NCT03735849, dan NCT03015181).
Sebuah penelitian yang menguji keamanan pemberian subkutan dari antibodi 10E8V-LS (NCT03565315) dihentikan karena reaktogenisitas lokal. Sebuah studi yang mengevaluasi kombinasi antibodi bNAb 3BNC117 dan 1010--74 menunjukkan profil keamanan yang menguntungkan .dan studi kombinasi bNAb lainnya saat ini sedang berlangsung menggunakan PGT121 dan PGDM1400 atau PGT121 dan VRC07--523LS (NCT03205917 dan NCT03721510).
Studi pengujian antibodi bi dan tri-spesifik yang direkayasa saat ini sedang dikembangkan. Sementara tidak ada data tentang kemanjuran perlindungan bNAbs terhadap akuisisi HIV-1 pada manusia saat ini tersedia, penelitian AMP (pencegahan yang dimediasi antibodi) yang terdiri dari dua uji coba terkontrol plasebo acak besar sedang mengevaluasi efek perlindungan infus dengan VRC01 setiap dua bulan. pada wanita yang tinggal di sub-Sahara Afrika (HVTN 703/HPTN 081, NCT02568215) dan pada pria dan transgender yang berhubungan seks dengan pria (HVTN 704/HPTN 085, NCT02716675).
Hasil uji coba diharapkan segera. Penelitian ini sangat penting sebagai bukti konsep baru, jika imunisasi pasif memiliki potensi untuk melindungi terhadap penularan HIV-1, namun dengan bukti dari model praklinis yang menunjukkan bahwa satu bNAb mungkin tidak cukup luas untuk menetralkan paparan virus yang beragam, mengevaluasi kemanjuran koktail bNAb atau antibodi multi-spesifik kemungkinan besar akan menjadi langkah logis berikutnya dalam memajukan antibodi sebagai strategi pencegahan HIV-1.
BIODISTRIBUSI bNAbs
Mencapai dan mempertahankan kadar serum di atas konsentrasi ambang batas merupakan persyaratan penting untuk perlindungan yang efektif dan mengharuskan bNAbs diberikan berulang kali. Dalam model NHP-SHIV, menggunakan virus yang sangat sensitif terhadap bNAb yang diuji, perlindungan dapat dicapai dengan konsentrasi serum dalam kisaran 1--10 g/ml dan bahkan lebih rendah dengan beberapa antibodi puncak V2 yang sangat kuat seperti CAP256- VRC26.25 .
Salah satu pendekatan untuk memperpanjang waktu paruh konsentrasi serum antibodi in-vivo adalah pengenalan dua mutasi asam amino (M428L/N434S - LS) ke dalam wilayah Fc untuk meningkatkan pengikatan ke reseptor Fc neonatal (FcRn) . Modifikasi ini menghasilkan periode perlindungan yang sangat lama pada kera menggunakan mis. antibodi 10-1074LS dan 3BNC117LS . dan banyak bNAb yang sedang dalam evaluasi klinis diproduksi sebagai varian LS. Namun, selain konsentrasi serum, bNAbs kemungkinan besar perlu mencapai konsentrasi mukosa dan jaringan yang cukup untuk memblokir infeksi sebelum distribusi sistemik virus.
bNAbs ditemukan dalam sekresi mukosa setelah pemberian IV menunjukkan bahwa mereka didistribusikan secara sistemik . Sebuah studi pada bayi kera yang melakukan pengorbanan serial untuk menentukan kinetika distribusi jaringan mAb mendeteksi SIVIG poliklonal tetapi juga bNAbs monoklonal di seluruh jaringan limfoid. Selain itu, pembersihan infeksi yang dimediasi PGT121 diamati pada jaringan distal pada kera dewasa setelah tantangan SHIV-SF162P3 . menunjukkan i) perlunya bNAbs untuk memblokir infeksi di luar permukaan mukosa tetapi ii) bahwa tingkat jaringan yang cukup dicapai setelah IV tunggal dosis.
Sementara bNAb tampaknya mendistribusikan ke sebagian besar organ, permeabilitas rendah dari penghalang darah-otak membatasi transfer bNAb ke dalam sistem saraf pusat (SSP). Telah disarankan bahwa SSP dapat menampung varian HIV-1 yang lebih resisten terhadap bNAbs daripada yang terdeteksi dalam darah tepi namun, ini mungkin lebih menjadi perhatian untuk pendekatan terapeutik menggunakan bNAbs daripada untuk strategi perlindungan.
PERAN FUNGSI EFEKTOR ANTIBODI DALAM PERLINDUNGAN
Data dari NHP dan studi tikus . menunjukkan bahwa membersihkan sel yang terinfeksi dalam darah dan jaringan adalah bagian dari aktivitas protektif bNAbs dan diperlukan untuk mencegah penyebaran infeksi sistemik. Lebih lanjut, peran antibodi yang diperantarai Fc dalam mengurangi virus pendiri yang ditransmisikan atau mengendalikan viremia pasca-infeksi telah ditunjukkan pada kera rhesus.
Peneliti Lu et al mendemonstrasikan dalam model tikus yang dimanusiakan, bahwa setelah mengikat sel yang terinfeksi, bNAb 3BNC117 dapat merekrut fagositosis yang dimediasi sel yang bergantung pada antibodi (ADCP) dan sitotoksisitas (ADCC) yang bergantung pada antibodi yang bergantung pada FcR dan dengan demikian mampu mendorong eliminasi virus yang terinfeksi. Sel T CD4+ .Meskipun masih perlu ditunjukkan apakah perlindungan sterilisasi dapat dicapai dengan antibodi fungsional tetapi non-penetral, telah disarankan bahwa aktivitas anti-virus yang dimediasi Fc dapat meningkatkan kemanjuran perlindungan antibodi penetralisir. Selain itu, banyak penelitian telah menunjukkan korelasi kuat antara titer serum antibodi mediasi ADCC spesifik HIV-1 dan peningkatan hasil klinis.
Pengontrol HIV yang mempertahankan muatan virus yang tidak terdeteksi tanpa terapi antiretroviral diperkaya dengan antibodi polifungsional (61). Namun, ketika poli-IgG dari pengontrol HIV secara pasif ditransfer ke NHP, tidak ada perlindungan terhadap tantangan SHIV yang diamati, berpotensi karena jumlah antibodi fungsional yang relatif rendah dalam total poli-IgG yang diberikan . Selain itu, kemanjuran antibodi fungsional sangat bergantung pada ketersediaan sel efektor di tempat penularan HIV-1 . dan dipengaruhi oleh afinitas terhadap FcR yang berbeda antar spesies . Antibodi non-penetral mungkin juga berbeda dalam kemampuannya untuk mengikat trimer Env asli dan struktur monomer dibandingkan dengan bNAbs . yang mungkin menjelaskan perbedaan dalam kemampuan untuk memediasi ADCC efektif melawan sel yang terinfeksi.
Mengingat pentingnya wilayah Fc untuk bNAbs untuk tidak hanya memblokir infeksi tetapi juga membersihkan sel yang terinfeksi, banyak modifikasi Fc, termasuk mutasi titik Fc dan varian glikan Fc sedang dieksplorasi untuk meningkatkan pengikatan FcyR dan induksi fungsi antivirus . Pemahaman yang lebih baik tentang bioaktivitas dari profil Fc yang berbeda yang memaksimalkan perlindungan terhadap infeksi pada permukaan mukosa yang berbeda akan sangat penting untuk keberhasilan dan implementasi global bNAb untuk pencegahan.
MODULASI IMUN HOST OLEH bNAbs
Distribusi bNAb ke dalam jaringan limfoid dan co-lokalisasi dengan virus setelah infeksi sistemik dan bahkan berpotensi paparan lokal memungkinkan pembentukan kompleks imun (IC) dan telah didalilkan bahwa IC ini dapat meningkatkan respon imun anti-virus . Memang, pada orang yang terinfeksi HIV-1 yang diberikan 3BNC117, perluasan tanggapan antibodi penetralisir autologus dilaporkan . dan efeknya lebih menonjol di antara subyek dengan viremia yang terdeteksi. Perawatan awal kera remaja yang terinfeksi SIV dengan IgG penetral spesifik SIV (SIVIG) mempercepat pengembangan NAb hingga 20 minggu . dan studi kedua mengkonfirmasi bahwa hanya SHIVIG yang sangat spesifik untuk tantangan SHIV SF162P3, oleh karena itu mempertahankan kemampuan untuk menghasilkan IC, menghasilkan efek ini .. Selain induksi kekebalan humoral, pemberian koktail bNAb selama infeksi SHIV akut kera rhesus menghasilkan 6/13 monyet yang mempertahankan muatan virus HIV plasma yang tidak terdeteksi setelah pembersihan bNAb dan penipisan sel T CD8 mengakibatkan kemunculan kembali viremia plasma yang menunjukkan a Efek kontrol yang dimediasi sel T CD8.
Sebaliknya, dosis tunggal PGT121 atau N6LS atau kombinasi keduanya yang diberikan kepada kera yang terinfeksi SHIV SF-162P3 kronis tidak menghasilkan peningkatan titer antibodi penetralisir autologus di atas apa yang diamati pada hewan kontrol plasebo .Pemberian 3BNC117 berulang pada manusia sebelum dan selama penghentian pengobatan antiretroviral mengakibatkan pemulihan virus yang tertunda, namun, besarnya dan luasnya sel T spesifik HIV tampaknya tidak berkembang setelah infus bNAb dengan peringatan bahwa tidak ada kelompok kontrol untuk membandingkan T- respon sel terhadap. Aspek yang berbeda dari efek vaksin dari terapi bNAb juga dibahas dalam ulasan oleh Naranjo-Gomez & Pelegrin dkk dalam edisi ini ..
`MASA DEPAN: ISOTIPE LAIN DAN mAbs YANG DIREKAYASA
Sementara IgG mendominasi jalur pengembangan saat ini untuk bNAbs monoklonal, isotipe lain memiliki fitur menarik yang menyarankan mereka sebagai alternatif potensial untuk strategi pencegahan berbasis antibodi. IgM, yang diakui sebagai penanggap pertama terhadap patogen, menjalankan aviditas/afinitas tinggi terhadap target mereka, memiliki kemampuan yang ditingkatkan untuk memperbaiki komplemen dan secara efisien membentuk kompleks imun oleh karena itu dipertimbangkan sebagai adjuvant vaksin .. IgM monoklonal rekombinan yang dihasilkan dengan daerah variabel rantai berat dan ringan dari IgG1 Nab mencegah transmisi SHIV pada kera rhesus yang ditantang secara mukosa . Namun, waktu paruh yang berpotensi pendek, ketergantungan pada penargetan epitop yang menonjol karena konformasi dan ukuran IgM dan kurangnya kapasitas untuk menginduksi fungsi yang dimediasi Fc non-pelengkap adalah kemungkinan hambatan yang perlu diatasi. IgA sekretori (SIgA) memainkan peran penting dalam imunitas mukosa dan tampak jelas sebagai isotipe untuk strategi yang ditujukan untuk mencegah infeksi pada permukaan mukosa.
Memang, SIgA mukosa telah disarankan untuk dikaitkan dengan peningkatan perlindungan terhadap infeksi menular melalui vagina termasuk HIV-1 . dan influenza .tetapi tanggapan IgA yang diinduksi vaksin juga telah dikaitkan dengan peningkatan risiko infeksi selama uji coba vaksin RV144 . Namun, analisis jaringan baru-baru ini menunjukkan bahwa respons IgA tidak mungkin menyebabkan gangguan perlindungan imun humoral, tetapi lebih mengindikasikan respons imun humoral yang tidak terkoordinasi secara keseluruhan dan karena itu kurang fungsional. Sebuah studi menggunakan IgA1 yang diterapkan secara rektal menghasilkan tingkat perlindungan yang lebih tinggi terhadap SHIV yang ditularkan dalam model NHP (83). Crosslinking FcRI oleh kompleks imun IgA menghasilkan aktivasi neutrofil yang poten dan fungsi efektor pro-inflamasi, termasuk perekrutan neutrofil (diulas dalam ... Jika pemberian IgA intravena akan menghasilkan tingkat protektif dari penetralan dan/atau SIgA fungsional pada permukaan mukosa perlu ditentukan Selain rekayasa antibodi bi-atau tri-spesifik, misalnya seperti yang dibahas sebelumnya, beberapa kelompok telah mengejar penargetan situs pengikatan CD4 yang dilestarikan, dan situs pengikatan koreseptor . misalnya eCD4-Ig . menunjukkan luas netralisasi yang luar biasa terhadap sebagian besar strain HIV-1 yang diuji, terlepas dari preferensi clade atau koreseptor, termasuk strain yang resisten terhadap beberapa antibodi situs pengikatan CD4 seperti VRC01 dan 3BNC117 tetapi juga menunjukkan aktivitas melawan SIV dan Strain HIV-2. Disampaikan melalui rekombinan adeno-associated virus (rAAV), kera rhesus mengekspresikan tingkat rh-eCD4-Ig dan dilindungi terhadap tantangan SHIV-AD8 yang menginfeksi semua hewan kontrol .
TERAPI ANTIBODI MONOKLONAL PENETRALISIR
Studi awal menggunakan antibodi monoklonal penetralisir sebagai terapi melawan HIV-1 pada tikus . gagal menunjukkan efek substansial pada viral load plasma, tetapi campuran antibodi pada waktu itu adalah penetral yang buruk dibandingkan dengan bNAb yang saat ini sedang dikembangkan.
Bidang terapi HIV-1 berbasis antibodi mendapatkan kembali momentumnya ketika bNAbs generasi kedua tersedia Efek antivirus in-vivo dari bNAb ini secara substansial lebih menjanjikan, mengurangi viremia plasma dan mempertahankan penekanan virologi pada tikus manusia yang ditekan ART setelah penghentian ART.
Kombinasi dari setidaknya tiga antibodi, menargetkan situs Env yang tidak tumpang tindih, menghasilkan penekanan infeksi HIV-1 YU2 yang dipertahankan pada subset tikus . dan juga menyebabkan pengurangan DNA HIV-1 terkait sel . Administrasi bNAbs tunggal, bagaimanapun, mengakibatkan munculnya varian viral escape dengan cepat
Baru-baru ini, Schommers at al melaporkan bahwa antibodi situs pengikatan CD4 baru yang sangat luas dan kuat, 1--18, viremia yang sepenuhnya ditekan pada tikus manusia yang terinfeksi HIV-1 YU2 tanpa memilih varian virus yang resisten menunjukkan bahwa antibodi tertentu memiliki bar yang lebih tinggi untuk melarikan diri virus. Pada kera rhesus, pemberian intravena bNAbs individu PGT121, 10-1074 atau 3BNC117 menghasilkan kontrol virologis sementara pada hewan yang terinfeksi SHIV kronis dan pengurangan tingkat DNA HIV-1 dalam jaringan diamati setelah terapi PGT121 .
Sementara kombinasi 3BNC117 dan 10-1074 menyebabkan pengendalian kera yang terinfeksi viremia SHIV-AD8 tanpa bukti melarikan diri, sementara masing-masing antibodi sendiri dipilih untuk strain virus rebound dengan mutasi lolos netralisasi . Menggabungkan dua bNAbs N6 dan PGT121 untuk mengobati infeksi SHIV-SF162P3, virus dengan sensitivitas yang sangat baik terhadap kedua antibodi, tidak menunjukkan efek antivirus tambahan pada kera tetapi menghasilkan penurunan tingkat DNA proviral secara signifikan di PBMC setelah 2 minggu dan di kelenjar getah bening setelahnya. 10 minggu .
Sementara netralisasi langsung virion adalah salah satu fungsi utama bNAbs, dan secara langsung terkait dengan efek antivirus yang terlihat berkaitan dengan viremia plasma, fungsi tambahan yang dimediasi Fc berperan dalam menargetkan sel yang sudah terinfeksi dan oleh karena itu kemungkinan dapat berkontribusi pada pengendalian virus .
Memang, Lu et al. ditunjukkan dalam model tikus yang dimanusiakan, bahwa setelah mengikat sel yang terinfeksi, bNAb 3BNC117 dapat merekrut fagositosis yang dimediasi sel yang bergantung pada antibodi (ADCP) dan sitotoksisitas (ADCC) dengan cara yang bergantung pada FcR dan dengan demikian mampu mendorong anti-reservoir aktivitas bNAb dengan menggabungkan dengan modulator imun dan agen pembalikan latensi.
Secara khusus, yang terakhir kemungkinan penting untuk menginduksi ekspresi protein virus, oleh karena itu membuat sel yang terinfeksi secara laten dapat menerima pengenalan antibodi dan pembersihan yang dimediasi imun. Tikus manusia yang terinfeksi HIV-1 YU2 diobati dengan kombinasi Vorinostat, anti-CTLA4 dan I-BET151, penghambat protein BET, setelah penekanan virus dengan koktail bNAb. Strategi ini mencegah pemulihan virus pada 57% tikus, sementara sebagian besar tikus yang hanya menerima antibodi mengalami peningkatan. Lebih lanjut, kera rhesus yang terinfeksi dengan infeksi SHIV-SF162P3 yang disupresi ART menerima agonis TLR7 (Vesatolimod), PGT121, atau kombinasi keduanya. Setelah washout PGT121, subset (5/11) dari kera yang telah menerima kedua agen tidak rebound menunjukkan efek anti-reservoir dari terapi kombinasi
Terlepas dari hasil yang menjanjikan ini, standar untuk mereplikasi hasil ini pada manusia yang terinfeksi secara kronis kemungkinan jauh lebih tinggi, mengingat ukuran reservoir yang lebih besar dan lebih beragam pada manusia dibandingkan dengan tikus yang dimanusiakan atau kera yang terinfeksi SHIV strain tunggal.
KESIMPULAN
Sampai vaksin pelindung tersedia, strategi imunisasi pasif menggunakan antibodi penetralisir luas bisa menjadi alternatif yang menjanjikan untuk mencegah penularan infeksi HIV-1. Sementara metode pencegahan kerja panjang lainnya, selain bNAbs, juga sedang dikembangkan, termasuk pelepasan berkelanjutan dalam tubuh penderita.
Daftar Pustaka
- Julg, B., & Barouch, D. H. (2019). Neutralizing antibodies for HIV-1 prevention. Current Opinion in HIV and AIDS, 14(4), 318.
- Julg, B., & Barouch, D. (2021, April). Broadly neutralizing antibodies for HIV-1 prevention and therapy. In Seminars in Immunology (p. 101475). Academic Press.
- Walker LM, Phogat SK, Chan-Hui PY, Wagner D, Phung P, Goss JL, et al. Broad and potent neutralizing antibodies from an African donor reveal a new HIV-1 vaccine target. Science. 2009;326(5950):285--9. [PMC free article] [PubMed] [Google Scholar]
- Wu X, Yang ZY, Li Y, Hogerkorp CM, Schief WR, Seaman MS, et al. Rational design of envelope identifies broadly neutralizing human monoclonal antibodies to HIV-1. Science. 2010;329(5993):856--61. [PMC free article] [PubMed] [Google Scholar]
- Walker LM, Huber M, Doores KJ, Falkowska E, Pejchal R, Julien JP, et al. Broad neutralization coverage of HIV by multiple highly potent antibodies. Nature. 2011;477(7365):466--70. [PMC free article] [PubMed] [Google Scholar]
- Scheid JF, Mouquet H, Feldhahn N, Seaman MS, Velinzon K, Pietzsch J, et al. Broad diversity of neutralizing antibodies isolated from memory B cells in HIV-infected individuals. Nature. 2009;458(7238):636--40. [PubMed] [Google Scholar]
- Burton DR, Mascola JR. Antibody responses to envelope glycoproteins in HIV-1 infection. Nature immunology. 2015;16(6):571--6. [PMC free article] [PubMed] [Google Scholar]
- Sok D, Burton DR. Recent progress in broadly neutralizing antibodies to HIV. Nature immunology. 2018;19(11):1179--88. [PMC free article] [PubMed] [Google Scholar]
- Scheid JF, Mouquet H, Ueberheide B, Diskin R, Klein F, Oliveira TY, et al. Sequence and structural convergence of broad and potent HIV antibodies that mimic CD4 binding. Science. 2011;333(6049):1633--7. [PMC free article] [PubMed] [Google Scholar]
Baca konten-konten menarik Kompasiana langsung dari smartphone kamu. Follow channel WhatsApp Kompasiana sekarang di sini: https://whatsapp.com/channel/0029VaYjYaL4Spk7WflFYJ2H