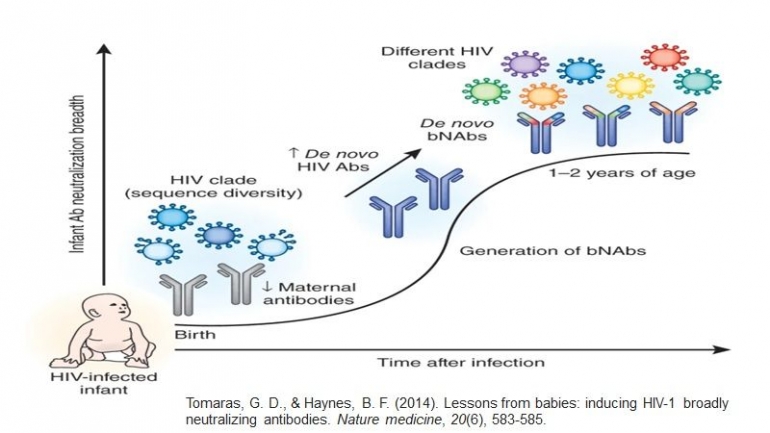
Bidang terapi HIV-1 berbasis antibodi mendapatkan kembali momentumnya ketika bNAbs generasi kedua tersedia Efek antivirus in-vivo dari bNAb ini secara substansial lebih menjanjikan, mengurangi viremia plasma dan mempertahankan penekanan virologi pada tikus manusia yang ditekan ART setelah penghentian ART.
Kombinasi dari setidaknya tiga antibodi, menargetkan situs Env yang tidak tumpang tindih, menghasilkan penekanan infeksi HIV-1 YU2 yang dipertahankan pada subset tikus . dan juga menyebabkan pengurangan DNA HIV-1 terkait sel . Administrasi bNAbs tunggal, bagaimanapun, mengakibatkan munculnya varian viral escape dengan cepat
Baru-baru ini, Schommers at al melaporkan bahwa antibodi situs pengikatan CD4 baru yang sangat luas dan kuat, 1--18, viremia yang sepenuhnya ditekan pada tikus manusia yang terinfeksi HIV-1 YU2 tanpa memilih varian virus yang resisten menunjukkan bahwa antibodi tertentu memiliki bar yang lebih tinggi untuk melarikan diri virus. Pada kera rhesus, pemberian intravena bNAbs individu PGT121, 10-1074 atau 3BNC117 menghasilkan kontrol virologis sementara pada hewan yang terinfeksi SHIV kronis dan pengurangan tingkat DNA HIV-1 dalam jaringan diamati setelah terapi PGT121 .
Sementara kombinasi 3BNC117 dan 10-1074 menyebabkan pengendalian kera yang terinfeksi viremia SHIV-AD8 tanpa bukti melarikan diri, sementara masing-masing antibodi sendiri dipilih untuk strain virus rebound dengan mutasi lolos netralisasi . Menggabungkan dua bNAbs N6 dan PGT121 untuk mengobati infeksi SHIV-SF162P3, virus dengan sensitivitas yang sangat baik terhadap kedua antibodi, tidak menunjukkan efek antivirus tambahan pada kera tetapi menghasilkan penurunan tingkat DNA proviral secara signifikan di PBMC setelah 2 minggu dan di kelenjar getah bening setelahnya. 10 minggu .
Sementara netralisasi langsung virion adalah salah satu fungsi utama bNAbs, dan secara langsung terkait dengan efek antivirus yang terlihat berkaitan dengan viremia plasma, fungsi tambahan yang dimediasi Fc berperan dalam menargetkan sel yang sudah terinfeksi dan oleh karena itu kemungkinan dapat berkontribusi pada pengendalian virus .
Memang, Lu et al. ditunjukkan dalam model tikus yang dimanusiakan, bahwa setelah mengikat sel yang terinfeksi, bNAb 3BNC117 dapat merekrut fagositosis yang dimediasi sel yang bergantung pada antibodi (ADCP) dan sitotoksisitas (ADCC) dengan cara yang bergantung pada FcR dan dengan demikian mampu mendorong anti-reservoir aktivitas bNAb dengan menggabungkan dengan modulator imun dan agen pembalikan latensi.
Secara khusus, yang terakhir kemungkinan penting untuk menginduksi ekspresi protein virus, oleh karena itu membuat sel yang terinfeksi secara laten dapat menerima pengenalan antibodi dan pembersihan yang dimediasi imun. Tikus manusia yang terinfeksi HIV-1 YU2 diobati dengan kombinasi Vorinostat, anti-CTLA4 dan I-BET151, penghambat protein BET, setelah penekanan virus dengan koktail bNAb. Strategi ini mencegah pemulihan virus pada 57% tikus, sementara sebagian besar tikus yang hanya menerima antibodi mengalami peningkatan. Lebih lanjut, kera rhesus yang terinfeksi dengan infeksi SHIV-SF162P3 yang disupresi ART menerima agonis TLR7 (Vesatolimod), PGT121, atau kombinasi keduanya. Setelah washout PGT121, subset (5/11) dari kera yang telah menerima kedua agen tidak rebound menunjukkan efek anti-reservoir dari terapi kombinasi
Terlepas dari hasil yang menjanjikan ini, standar untuk mereplikasi hasil ini pada manusia yang terinfeksi secara kronis kemungkinan jauh lebih tinggi, mengingat ukuran reservoir yang lebih besar dan lebih beragam pada manusia dibandingkan dengan tikus yang dimanusiakan atau kera yang terinfeksi SHIV strain tunggal.
KESIMPULAN
Sampai vaksin pelindung tersedia, strategi imunisasi pasif menggunakan antibodi penetralisir luas bisa menjadi alternatif yang menjanjikan untuk mencegah penularan infeksi HIV-1. Sementara metode pencegahan kerja panjang lainnya, selain bNAbs, juga sedang dikembangkan, termasuk pelepasan berkelanjutan dalam tubuh penderita.
Daftar Pustaka
- Julg, B., & Barouch, D. H. (2019). Neutralizing antibodies for HIV-1 prevention. Current Opinion in HIV and AIDS, 14(4), 318.
- Julg, B., & Barouch, D. (2021, April). Broadly neutralizing antibodies for HIV-1 prevention and therapy. In Seminars in Immunology (p. 101475). Academic Press.
- Walker LM, Phogat SK, Chan-Hui PY, Wagner D, Phung P, Goss JL, et al. Broad and potent neutralizing antibodies from an African donor reveal a new HIV-1 vaccine target. Science. 2009;326(5950):285--9. [PMC free article] [PubMed] [Google Scholar]
- Wu X, Yang ZY, Li Y, Hogerkorp CM, Schief WR, Seaman MS, et al. Rational design of envelope identifies broadly neutralizing human monoclonal antibodies to HIV-1. Science. 2010;329(5993):856--61. [PMC free article] [PubMed] [Google Scholar]
- Walker LM, Huber M, Doores KJ, Falkowska E, Pejchal R, Julien JP, et al. Broad neutralization coverage of HIV by multiple highly potent antibodies. Nature. 2011;477(7365):466--70. [PMC free article] [PubMed] [Google Scholar]
- Scheid JF, Mouquet H, Feldhahn N, Seaman MS, Velinzon K, Pietzsch J, et al. Broad diversity of neutralizing antibodies isolated from memory B cells in HIV-infected individuals. Nature. 2009;458(7238):636--40. [PubMed] [Google Scholar]
- Burton DR, Mascola JR. Antibody responses to envelope glycoproteins in HIV-1 infection. Nature immunology. 2015;16(6):571--6. [PMC free article] [PubMed] [Google Scholar]
- Sok D, Burton DR. Recent progress in broadly neutralizing antibodies to HIV. Nature immunology. 2018;19(11):1179--88. [PMC free article] [PubMed] [Google Scholar]
- Scheid JF, Mouquet H, Ueberheide B, Diskin R, Klein F, Oliveira TY, et al. Sequence and structural convergence of broad and potent HIV antibodies that mimic CD4 binding. Science. 2011;333(6049):1633--7. [PMC free article] [PubMed] [Google Scholar]