Perlu diketahui bahwa, temuan terbaru: Transfer pasif bNAbs generasi kedua menghasilkan perlindungan yang tidak efektif terhadap infeksi pada model hewan praklinis. Lebih lanjut, beberapa bNAb yang menargetkan epitop yang berbeda pada trimer amplop HIV-1 sedang dalam evaluasi klinis dan telah menunjukkan profil keamanan yang menguntungkan dan aktivitas antivirus yang kuat pada individu yang terinfeksi secara kronis. Konfirmasi bahwa imunisasi pasif dengan bNAb(s) akan mencegah akuisisi HIV-1 pada manusia tertunda dan fokus penyelidikan yang sedang berlangsung. Mengingat keragaman global HIV-1, kombinasi bNAb atau antibodi multispesifik kemungkinan besar akan diperlukan untuk menghasilkan keluasan yang diperlukan untuk perlindungan yang efektif.
Hasil yang menggembirakan dari studi praklinis dan klinis mendukung pengembangan bNAb untuk pencegahan dan sejumlah antibodi dengan luas dan potensi luar biasa tersedia untuk evaluasi klinis. Optimalisasi lebih lanjut dari cakupan virus dan waktu paruh antibodi akan mempercepat implementasi klinis bNAbs sebagai alat penting untuk strategi pencegahan HIV-1.
PERJALAN VAKSI HIV
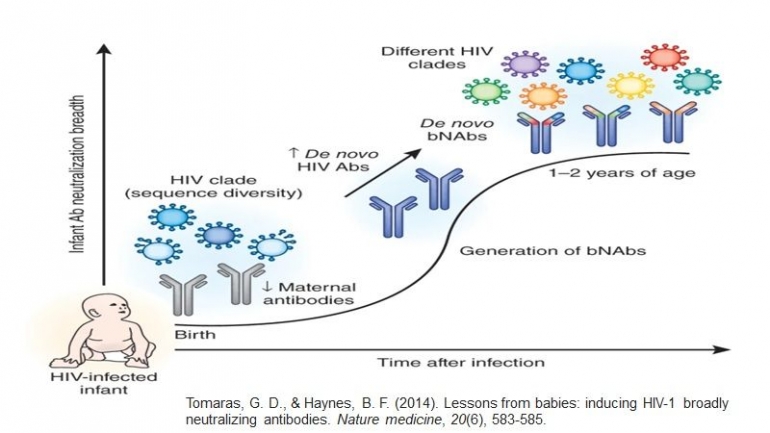
Meskipun upaya penelitian yang signifikan selama lebih dari tiga dekade, vaksin pelindung terhadap HIV-1 telah sulit dipahami. Oleh karena itu, pendekatan alternatif untuk pencegahan HIV-1 diperlukan sampai strategi vaksin yang berhasil ditemukan. Gagasan pemberian antibodi penetralisir pasif telah dikemukakan sejak awal, namun kurangnya kemanjuran menggunakan antibodi penetral generasi pertama (nAb) dengan potensi terbatas dan luasnya mengurangi antusiasme untuk pendekatan ini.
Dengan diperkenalkannya uji netralisasi keluaran tinggi yang dapat direproduksi dalam kombinasi dengan pengurutan reseptor sel B tunggal menggunakan probe amplop HIV-1 untuk menyortir sel B spesifik HIV-1 , generasi baru antibodi penetralisir yang sangat kuat dan luas (bNAbs) telah diidentifikasi. Sosok bNAb generasi baru ini hingga 100 kali lipat lebih kuat daripada antibodi generasi pertama dan menunjukkan keluasan netralisasi yang signifikan terhadap strain HIV-1.
Beberapa antibodi terhadap berbagai situs kerentanan pada trimer amplop HIV-1 telah dijelaskan menargetkan situs pengikatan CD4 gp120, situs V2-glikan di puncak trimer Env, situs V3-glikan, situs eksternal membran-proksimal. region (MPER) dari gp41, dan baru-baru ini region antarmuka antara gp120 dan gp41.
Dalam tinjauan berikut, akan membahas kemajuan yang telah dicapai dalam mengevaluasi peran potensial antibodi penetralisir dalam mencegah infeksi HIV-1 dan kami saya akan menyoroti hambatan dan jalan potensial di masa yang akan datang untuk pengembangan bNAb.
BUKTI PERLINDUNGAN ANTIBODI PADA HEWAN MODEL
Primata non-manusia (Non-human primates , NHP),. khususnya kera rhesus bayi dan dewasa, telah digunakan untuk memodelkan penularan HIV-1 alami oleh hewan yang berhadapan mukosa dengan chimeric simian-human immunodeficiency virus (SHIV) yang mengekspresikan amplop HIV-1 pada tulang punggung SIV.
Model ini memungkinkan untuk mengukur kemanjuran perlindungan imunoglobulin yang diberikan secara pasif dengan menantang hewan baik dengan SHIV dosis tinggi tunggal atau tantangan dosis rendah berulang setelah pemberian antibodi. Studi yang menggunakan model ini sejauh ini menunjukkan berbagai tingkat perlindungan, sebagian besar dipengaruhi oleh sensitivitas netralisasi dari stok tantangan terhadap antibodi yang diberikan ..
Penelitian Moldt dkk menunjukkan bahwa antibodi glikan V3 PGT121 sepenuhnya melindungi kera terhadap tantangan dosis tinggi dengan tingkat 2 SHIV-SF162P3 pada dosis 5 mg/kg dan 1 mg/kg pada konsentrasi serum antibodi 95 g/mL, dan 15 g /mL (23). BNAb kuat lainnya termasuk VRC01, VRC07--523, 3BNC117 dan 10--1074 juga telah menunjukkan perlindungan . dan PGDM1400 dan CAP256-VRC26.25 hewan yang dilindungi terhadap tantangan clade C SHIV-325c pada dosis 0,4 (PGDM1400) dan bahkan 0,08 mg/kg (CAP256-VRC26.25) dengan konsentrasi serum serendah 0,75 g/mL .