Beberapa hari yang lalu, kebetulan saya mendapatkan kesempatan untuk menghadiri Annual Conference International Society for Pharmaceutical Engineering (ISPE), sebuah organisasi internasional perindustrian farmasi se-Indonesia di Jakarta.
Dalam konferensi tahunan ini, kebetulan issue yang menjadi fokus utama adalah mengenai mutu atau kualitas. Baik itu mutu yang berkaitan dengan fasilitas produksi beserta seluruh bahan (material), peralatan dan perlengkapan yang digunakan, mutu proses pembuatan, hingga mutu produk akhir (finished good).
Dan salah satu topik yang menurut saya paling menarik dan sesuai dengan tren perkembangan produk di dunia industri farmasi adalah mengenai Produk Biosimilar. Topik ini disampaikan oleh perwakilan Badan Pengawas Obat dan Makanan (BPOM) RI sehingga fokus pembahasannya berpusat pada regulasi produk biosimilar di Indonesia.
Tren produk biosimilar sebenarnya sudah muncul sejak beberapa tahun yang lalu, namun karena kompleksitas dalam pembuatannya, hingga kini belum terlalu banyak produk biosimilar yang beredar di Indonesia.
Apa itu Produk Biosimilar?
Menurut peraturan Kepala BPOM nomor 17 tahun 2015 tentang Pedoman Penilaian Produk Biosimilar, definisi Produk Biosimilar atau Similar Biotherapeutic Product (SPB) atau Produk Biologi Sejenis (PBS) adalah produk biologi dengan profil khasiat, keamanan, dan mutu yang similar/serupa dengan produk biologi yang telah disetujui.
Dan yang termasuk dalam Produk Biologi adalah vaksin, imunosera, antigen, hormon, enzim, produk darah dan produk hasil fermentasi lainnya (termasuk antibodi monoklonal dan produk yang berasal dari teknologi DNA rekombinan).
Oleh sebab itu tentunya ilmu Bioteknologi akan menjadi salah satu cabang ilmu yang terus berkembang karena ikut memberi andil dalam penyediaan Produk Biologi untuk kepentingan terapi, preventif (pencegahan) dan penatalaksanaan penyakit keganasan.
Produk Biologi ini biasanya digunakan untuk mengobati penyakit-penyakit serius seperti, Multiple Sclerosis, penyakit genetik yang jarang, anemia dan defisiensi hormon pertumbuhan.
Jika dilihat dari definisinya, status Produk Biosimilar sebenarnya mirip dengan dengan obat copy atau obat generik karena diproduksi setelah masa paten obat originatornya habis.
Produk originator adalah produk (obat) yang dikembangkan untuk pertama kalinya oleh suatu produsen dan terdaftar berdasarkan data lengkap mutu, keamanan dan efikasi (khasiat) serta memiliki hak paten. Hak paten suatu produk originator biasanya berlangsung selama 20 tahun.
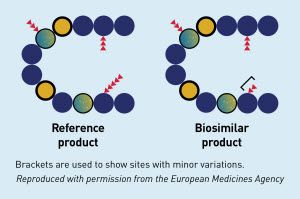
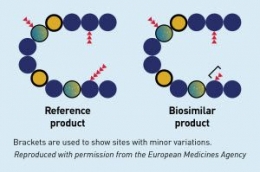
Produk Biologi terdiri dari molekul yang sangat kompleks, yang diproduksi dengan menggunakan sel makhluk hidup, protein, DNA dengan sifat-sifat yang sangat bervariasi. Oleh sebab itu untuk mempertahankan konsistensi kualitas produk dalam setiap bets saat proses produksi juga menjadi tantangan tersendiri.
Dalam beberapa kasus, perubahan sekecil apapun dalam proses produksi, distribusi maupun penyimpanan, bisa saja mempengaruhi perubahan profil keamanan dan khasiat produk akhir. Berbeda dengan obat hasil sintesis kimia.
Dan teknik analisis saat ini sayangnya belum mampu untuk bisa selalu membuktikan bahwa dua Produk Biologi sejenis sebagai produk yang identik. Oleh sebab itu, Produk Biosimilar diharuskan menyertakan hasil uji komparabilitas saat akan dikomersilkan di Indonesia.
Uji Komparabilitas ini bertujuan untuk membandingkan secara langsung (head to head) suatu produk biologi dengan originator atau obat serupa yang sudah terdaftar di Indonesia, untuk melihat kemiripan atau kesetaraan mutu, khasiat dan keamanan produk dalam penelitian yang menggunakan rancangan dan prosedur yang sama.
Jadi meskipun Uji Komparabilitas terfokus pada mutu produk, aspek keamanan (safety) dan khasiat (efficacy) juga perlu diperhatikan. Derajat kemiripan yang tinggi (semakin tinggi kemiripan) suatu Produk Biosimilar dengan originator-nya, dapat dijadikan dasar untuk mengurangi persyaratan non-klinik & klinik untuk memperoleh izin edar.
Dan karena teknologi saat ini belum bisa mengidentifikasi perbedaan secara spesifik antara produk Biosimilar dan originatornya, produsen produk biosimilar juga harus melakukan studi farmakovigilans, untuk mengawasi efek samping atau toksik dan profil keamanan lainnya yang mungkin muncul ketika sudah dikonsumsi oleh masyarakat secara lebih luas. Perlu diketahui bahwa beberapa obat, bisa jadi tidak menunjukkan efek samping tertentu dalam skala penelitian yang lebih kecil.
Oleh sebab itu, penting bagi setiap masyarakat (pasien atau dokter) untuk melaporkan efek samping sekecil apapun yang belum teridentifikasi atau tertulis dalam leaflet produk obat. Laporan ini bisa ditujukan ke produsen obat maupun ke otoritas regulator terkait (BPOM), dan dapat dijadikan dasar di kemudian hari apakah produk tersebut perlu dikaji ulang atau tidak.
Contoh Produk Biosimilar
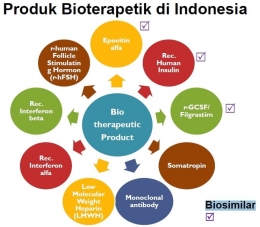
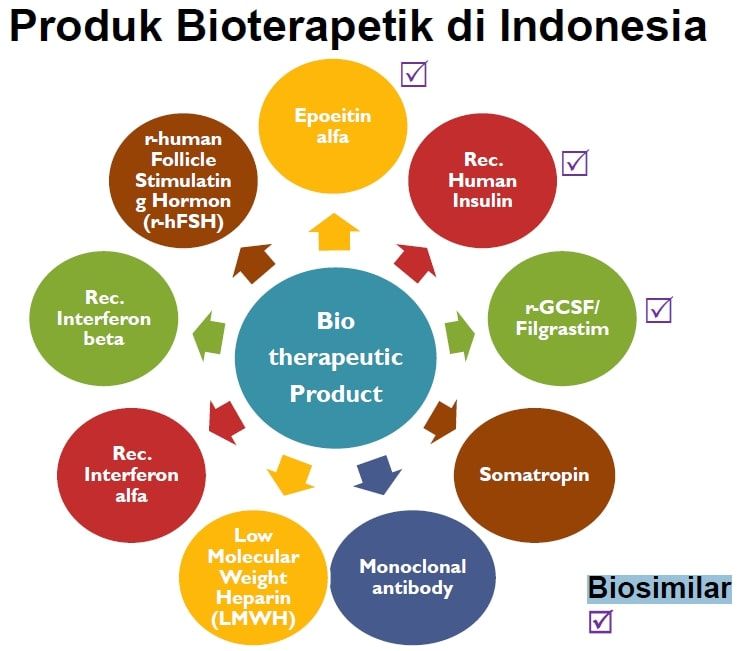
Secara keseluruhan ada 9 kategori produk bioterapeutik yakni Epoetin Alfa, Recombinant Human Insulin, Filgrastim, Somatotropin, Antibodi Monoklonal, Low Molecular Weight Heparin, Rec. Interferon Alfa, Rec. Interferon Beta, r-human FSH.
Empat diantaranya sudah terdaftar di Indonesia yakni kelas Antibodi Monoklonal untuk meningkatkan imunitas tubuh dalam pengobatan kanker (Rituximab dan Trastuzumab), Filgrastim dan Epoetin Alfa (faktor pembentukan sel darah untuk pasien yang kemampuan pembentukan sel darah di tubuhnya sudah rusak), serta Rekombinan Insulin Manusia dan Rekombinan Insulin Glargine (untuk pengobatan DM tipe 1).
Namun bukan berarti di masa depan produk Biosimilar tidak bisa menandingi produk generik dalam hal harga, terutama jika kita telah memiliki teknologi yang memadai untuk memproduksi sendiri seluruh obat-obat ini.
Plus Minus Produk Biosimilar
Jadi apa saja plus minus Produk Biosimilar bila dibandingkan dengan obat copy dan/atau obat generik?
Seperti yang sudah disinggung di atas bahwa produk Biosimilar dibuat dari senyawa (yang juga ada di tubuh kita) atau sel makhluk hidup, maka efek samping yang diimbulkan umumnya lebih kecil dan lebih mudah untuk dimetabolisme dalam tubuh, sehingga bisa jadi mengurangi resiko efek toksik yang mungkin akan muncul saat mengkonsumsi obat copy atau generik yang diproduksi secara sintetis kimia.
Hal ini tentunya sangat menguntungkan bagi pasien-pasien yang menderta penyakit parah seperti Diabetes Mellitus, hepatitis, kanker, hingga penyakit langka yang disebabkan kelainan genetik.
Namun produk Biosimilar ini juga memiliki kekurangan. Jika Apoteker bisa mensubstitusi (mengganti) obat paten (originator) ke obat generik atau obat copy bagi pasien yang membutuhkan, hal ini belum tentu bisa dilakukan terhadap obat Biosimilar.
Karena seperti yang sudah dijelaskan sebelumnya, produk Biosimilar yang diproduksi belum tentu memiliki profil mutu dan keamanan yang sama dengan produk pembanding atau originator-nya.
Baca konten-konten menarik Kompasiana langsung dari smartphone kamu. Follow channel WhatsApp Kompasiana sekarang di sini: https://whatsapp.com/channel/0029VaYjYaL4Spk7WflFYJ2H