Produk Biologi terdiri dari molekul yang sangat kompleks, yang diproduksi dengan menggunakan sel makhluk hidup, protein, DNA dengan sifat-sifat yang sangat bervariasi. Oleh sebab itu untuk mempertahankan konsistensi kualitas produk dalam setiap bets saat proses produksi juga menjadi tantangan tersendiri.
Dalam beberapa kasus, perubahan sekecil apapun dalam proses produksi, distribusi maupun penyimpanan, bisa saja mempengaruhi perubahan profil keamanan dan khasiat produk akhir. Berbeda dengan obat hasil sintesis kimia.
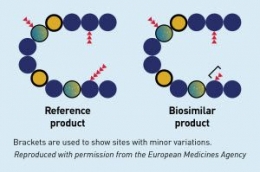
Dan teknik analisis saat ini sayangnya belum mampu untuk bisa selalu membuktikan bahwa dua Produk Biologi sejenis sebagai produk yang identik. Oleh sebab itu, Produk Biosimilar diharuskan menyertakan hasil uji komparabilitas saat akan dikomersilkan di Indonesia.
Uji Komparabilitas ini bertujuan untuk membandingkan secara langsung (head to head) suatu produk biologi dengan originator atau obat serupa yang sudah terdaftar di Indonesia, untuk melihat kemiripan atau kesetaraan mutu, khasiat dan keamanan produk dalam penelitian yang menggunakan rancangan dan prosedur yang sama.
Jadi meskipun Uji Komparabilitas terfokus pada mutu produk, aspek keamanan (safety) dan khasiat (efficacy) juga perlu diperhatikan. Derajat kemiripan yang tinggi (semakin tinggi kemiripan) suatu Produk Biosimilar dengan originator-nya, dapat dijadikan dasar untuk mengurangi persyaratan non-klinik & klinik untuk memperoleh izin edar.
Dan karena teknologi saat ini belum bisa mengidentifikasi perbedaan secara spesifik antara produk Biosimilar dan originatornya, produsen produk biosimilar juga harus melakukan studi farmakovigilans, untuk mengawasi efek samping atau toksik dan profil keamanan lainnya yang mungkin muncul ketika sudah dikonsumsi oleh masyarakat secara lebih luas. Perlu diketahui bahwa beberapa obat, bisa jadi tidak menunjukkan efek samping tertentu dalam skala penelitian yang lebih kecil.
Oleh sebab itu, penting bagi setiap masyarakat (pasien atau dokter) untuk melaporkan efek samping sekecil apapun yang belum teridentifikasi atau tertulis dalam leaflet produk obat. Laporan ini bisa ditujukan ke produsen obat maupun ke otoritas regulator terkait (BPOM), dan dapat dijadikan dasar di kemudian hari apakah produk tersebut perlu dikaji ulang atau tidak.
Contoh Produk Biosimilar
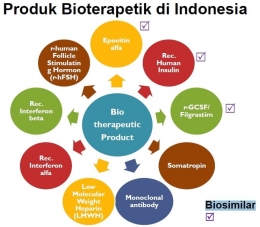
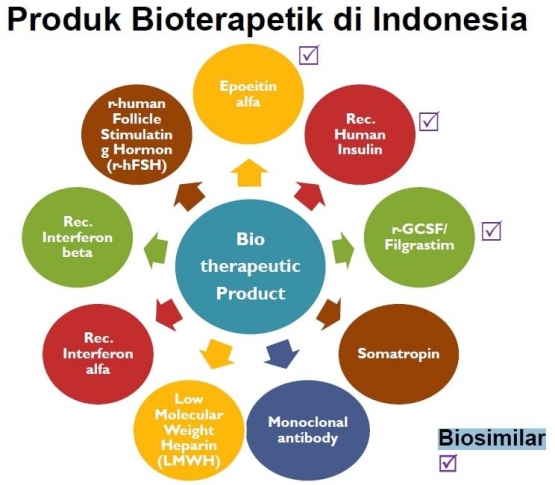
Secara keseluruhan ada 9 kategori produk bioterapeutik yakni Epoetin Alfa, Recombinant Human Insulin, Filgrastim, Somatotropin, Antibodi Monoklonal, Low Molecular Weight Heparin, Rec. Interferon Alfa, Rec. Interferon Beta, r-human FSH.
Empat diantaranya sudah terdaftar di Indonesia yakni kelas Antibodi Monoklonal untuk meningkatkan imunitas tubuh dalam pengobatan kanker (Rituximab dan Trastuzumab), Filgrastim dan Epoetin Alfa (faktor pembentukan sel darah untuk pasien yang kemampuan pembentukan sel darah di tubuhnya sudah rusak), serta Rekombinan Insulin Manusia dan Rekombinan Insulin Glargine (untuk pengobatan DM tipe 1).
Namun bukan berarti di masa depan produk Biosimilar tidak bisa menandingi produk generik dalam hal harga, terutama jika kita telah memiliki teknologi yang memadai untuk memproduksi sendiri seluruh obat-obat ini.