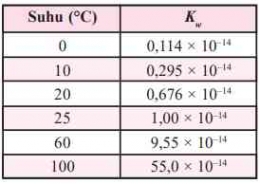
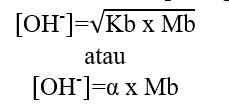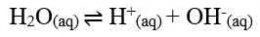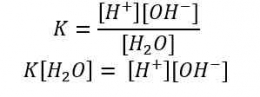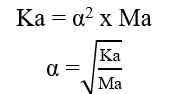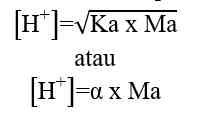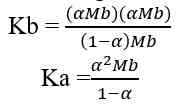b = valensi basa kuat
- Asam Lemah
Asam lemah dapat terionisasi secara sebagian dalam air. Dalam air, sebagian molekul asam lemah terurai menjadi ion-ionnya sehingga derajat ionisasinya 0 < α < 1.
Jika nilai α sangat kecil (α << 1), maka dapat diasumsikan nilai (1- α) = 1, sehingga persamaan Ka untuk asam lemah adalah sebagai berikut.
 Dokpri
Dokpri
Sehingga, untuk menghitung konsentrasi ion H+ dapat digunakan nilai Ka ataupun nilai α
 Dokpri
Dokpri
Keterangan:
Ka = tetapan ionisasi asam lemah
Ma = molaritas asam lemah
α = derajat ionisasi asam lemah
- Basa Lemah
Basa lemah dapat terionisasi secara sebagian dalam air. Dalam air, sebagian molekul asam lemah terurai menjadi ion-ionnya sehingga derajat ionisasinya 0 < α < 1.
Beri Komentar
Belum ada komentar. Jadilah yang pertama untuk memberikan komentar!