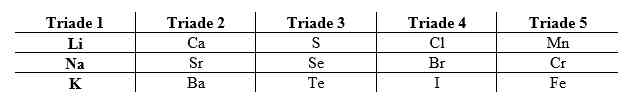
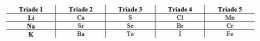
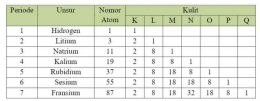
Dalam satu golongan, dari atas ke bawah jari-jari atom semakin besar yang karena jumlah kulit atom semakin bertambah. Dalam satu periode, dari kiri ke kanan jari-jari atomnya semakin kecil. Hal ini disebabkan karena unsur memiliki jumlah kulit yang sama dalam satu periode sedangkan jumlah elektron yang pada kulit dan proton pada inti atom bertambah. Sehingga menyebabkan terjadi gaya tarik menarik antara elektron dan proton yang semakin kuat sehingga jari-jari atomnya semakin kecil.
Energi ionisasi adalah energi minimum yang dibutuhkan suatu atom untuk melepaskan satu elektron terluar dalam fase gas. Energi ionisasi dapat dinyatakan dalam kJ mol-1. Semakin kecil energi ionisasi maka semakin mudah atom untuk melepaskan elektron. Sebaliknya, semakin besar energi ionisasi maka semakin sulit atom untuk melepaskan elektron. Besarnya nomor atom dan jari-jari atom dapat mempengaruhi harga energi ionisasi. Semakin besar jari-jari atom, maka semakin lemah gaya tarik inti terhadap elektron terluar. Hal tersebut berarti, elektron terluar akan lebih mudah lepas, sehingga energi yang dibutuhkan untuk melepaskan elektron terluar semakin kecil.
Dalam satu golongan, semakin ke bawah energi ionisasi semakin kecil, karena elektron terluar semakin jauh dari inti, sehingga elektron terluar semakin mudah untuk dilepaskan. Dalam satu periode, semakin ke kanan energi ionisasi semakin besar karena semakin ke kanan gaya tarik inti semakin kuat.
Afinitas elektron adalah besarnya energi yang dibutuhkan untuk menyertai proses pengikatan satu elektron pada satu atom netral dalam fase gas, sehingga terbentuk ion dengan muatan -1. Unsur dengan afinitas elektron bertanda negatif memiliki kecenderungan yang lebih besar untuk menyerap elektron daripada unsur dengan afinitas elektron bertanda positif. Semakin negatif nilai afinitas elektron, maka semakin besar kecenderungan suatu unsur untuk menyerap elektron atau kecenderungan untuk membentuk ion negatif.
Dalam satu periode dari kiri ke kanan, afinitas elektron cenderung bertambah besar karena jari-jari atom semakin kecil dan sehingga gaya tarik inti terhadap elektron semakin besar, dan semakin mudah atom untuk menarik elektron dari luar. Dalam satu golongan dari atas ke bawah, afinitas elektron cenderung berkurang karena jari-jari atom semakin besar, sehingga gaya tarik inti terhadap elektron semakin kecil, dan semakin sulit atom untuk menarik elektron dari luar.
4) Keelektronegatifan
Keelektronegatifan adalah kemampuan suatu atom untuk menarik elektron dari suatu atom dalam pembentukan ikatan kimia. Keelektronegatifan dapat diukur dengan menggunakan skala Pauling dengan besaran antara 0,7 sampai 4. Suatu unsur dengan harga keelektronegatifan yang besar cenderung menerima elektron dan akan membentuk ion negatif. Sedangkan unsur dengan harga keelektronegatifan kecil cenderung melepas elektron dan membentuk ion positif.
Dalam satu golongan, keelektronegatifan suatu unsur semakin kecil karena gaya tarik menarik inti semakin lemah. Dalam satu periode, keelektronegatifan suatu unsur semakin ke kanan akan semakin besar karena gaya tarik menarik inti semakin kuat. Perlu diingat bahwa golongan VIIIA tidak memiliki keelektronegatifan karena golongan VIIIA merupakan unsur-unsur golongan gas mulia yang sudah stabil dimana memiliki dua elektron valensi untuk He dan delapan elektron valensi untuk unsur-unsur yang lain. Sehingga keelektronegatifan terbesar pada setiap periode diperoleh oleh golongan VIIA yang termasuk unsur-unsur halogen.
Baca konten-konten menarik Kompasiana langsung dari smartphone kamu. Follow channel WhatsApp Kompasiana sekarang di sini: https://whatsapp.com/channel/0029VaYjYaL4Spk7WflFYJ2H