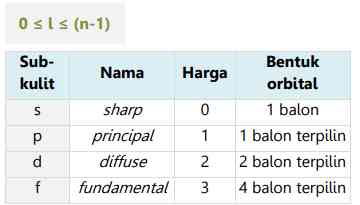
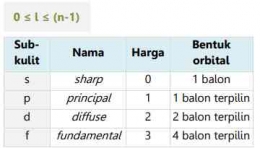
Elektron dengan harga l=2, artinya elektron tersebut berada pada sub kulit d (diffuse)
Elektron dengan harga l=3, artinya elektron tersebut berada pada sub kulit f (fundamental)
Berikut ini tabel terkait harga l yang diizinkan di setiap kulit:

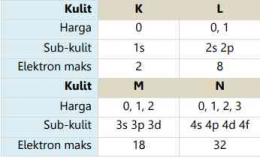
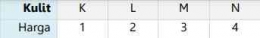
Berikut ini merupakan tabel kulit-kulit atom dalam keadaan penuh terisi elektron beserta harga bilangan kuantum azimuthnya:

Bilangan Kuantum Magnetik (m)
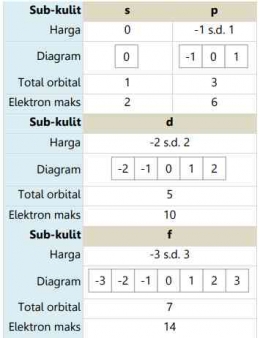
Bilangan Kuantum Magnetik dilambangkan dengaan huruf "m". Bilangan kuantum magnetic menyatakan orbital yang ditempati elektron dalam suatu sub kulit, suatu subkulit tersusun dari orbital-orbital, dan jumlah orbital yang dimiliki suatu sub kulit ditentukan oleh banyaknya harga m. Satu orbital maksimal berisi 2 elektron yang memiliki arah putar atau rotasi yang berlawanan. Nilai atau harga m merupakan deret bilangan bulat yang berkisar dari -m melalui nol sampai +m. Berikut ini tabel terkait sub kulit atom yang dalam keadaan penuh elektron beserta harga bilangan kuantum magnetiknya:

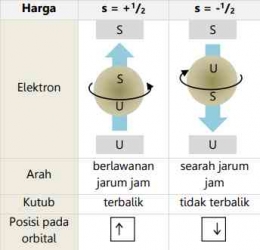
Bilangan Kuantum Spin (s)
Ketika Anda memikirkan elektron dalam atom, mungkin hal pertama yang terlintas dalam pikiran adalah gasing yang sedang berputar. Bagian atas gasing dapat diputar berlawanan arah jarum jam atau searah jarum jam. Dengan cara yang mirip, elektron yang menempati orbital juga berperilaku seperti gasing. Bilangan ini, dikenal sebagai bilangan kuantum keempat yaitu bilangan kuantum spin yang mencerminkan orientasi atau arah putaran elektron yang menempati orbital. Simbol yang digunakan untuk bilangan kuantum spin ini adalah "s".