Permasalahan umum yang dihadapi oleh para orangtua zaman sekarang adalah kurangnya minat baca anak, utamanya anak yang lebih menyukai menggeluti segala macam aplikasi di HPnya. Ini sebuah keadaan yang memprihatinkan.
Sebenarnya salah sebuah cara agar ketertarikan anak untuk belajar apa saja bisa ditingkatkan adalah dengan membaca buku apa pun dengan santai, bahkan sebagai hiburan, lihat semua artikel saya dalam topik Fisika untuk Hiburan.
Setelah ketertarikan sang anak tumbuh, bahkan merasa terhibur, barulah dia beranjak memasuki ketertarikan berikutnya, yaitu belajar rumus-rumus.
Kali ini kita jajaki bagaimana menumbuhkan ketertarikan anak belajar tentang atom dan molekul.
Di Rusia, Lomonosov (lihat artikel saya: Penemu Hukum Kekekalan Massa: Lavoiser atau Lomonosov?) meletakkan dasar ilmu atom dan molekul.
Pada 1741, dalam salah satu karya pertamanya, Unsur-unsur dari Kimia Matematis (Elements of Mathematical Chemistry), Lomonosov menyajikan usulan terpenting dari teori korpuskuler tentang struktur materi.
Catatan:
1. Istilah materi dan zat itu sama dan kapan masing-masing istilah ini kita gunakan bisa dilihat dari artikel saya: Sains Santai: Fisika dalam Kimia, Materi dan Gerak.
2. Korpuskuler (kata sifat) dan kospuskel (kata benda) masing-masing dipinjam dari istilah untuk menyebutkan sel darah merah yang dianggap sebagai materi terkecil pada masa Lomonosov.
Menurut Lomonosov, semua zat terbentuk dari partikel-partikel yang sangat kecil dan tidak sensitif, yang secara fisik tidak bisa dibagi dan memiliki kemampuan untuk saling berkohesi. Sifat-sifat zat tersebut disebabkan oleh sifat-sifat partikel-partikelnya.
Lomonosov membedakan 2 jenis partikel tersebut: yang lebih kecil disebut "unsur," sesuai dengan "atom" dalam interpretasi istilah itu saat ini, dan yang lebih besar, korpuskel, yang sekarang dikenal sebagai "molekul."
Komposisi setiap molekul sama dengan komposisi seluruh zat. Zat kimia yang berbeda juga memiliki molekul yang berbeda dalam komposisinya.
Molekul-molekul itu homogen jika terdiri dari jumlah yang sama dari unsur-unsur yang sama yang digabungkan dengan cara yang sama atau jumlah yang sama, dan heterogen jika terdiri dari unsur-unsur yang berbeda yang digabungkan dengan cara yang berbeda atau dalam jumlah yang berbeda.
Sekilas definisi di atas mengungkapkan bahwa Lomonosov melihat alasan mengapa zat-zat berbeda tidak hanya dalam komposisi molekul-molekul yang berbeda, tetapi juga dalam pengaturan yang berbeda dari unsur-unsur dalam sebuah molekul.
Lomonosov menekankan fakta bahwa molekul-molekul bergerak sesuai dengan hukum mekanika. Tanpa gerak, molekul-molekul tidak akan bisa bertabrakan satu sama lain atau bertindak satu sama lain untuk menghasilkan perubahan. Karena semua perubahan zat adalah akibat gerak molekul, maka perubahan kimiawi harus dipelajari tidak hanya dengan metode kimia, tetapi juga dengan metode fisika dan matematika.
Selama lebih dari 200 tahun yang telah berlalu sejak zaman Lomonosov, gagasannya tentang struktur materi diverifikasi secara komprehensif, dan kebenarannya dikonfirmasi sepenuhnya.
Saat ini, semua gagasan kita tentang struktur materi, tentang sifat-sifat zat, dan sifat fenomena fisika dan kimia didasarkan pada konsep atom dan molekul.
Landasan konsep atom dan molekul adalah prinsip keberlainan (diskontinuitas struktur) suatu zat. Zat bukanlah sesuatu yang padat atau kontinu, tetapi terdiri dari partikel-partikel individual yang sangat kecil.
Perbedaan antara zat-zat adalah karena perbedaan antara partikel-partikel masing-masing zat itu. Partikel-partikel dari zat tunggal adalah identik, sedangkan partikel-partikel dari zat yang berbeda juga berbeda.
Partikel-partikel suatu zat bergerak dalam segala kondisi, semakin tinggi temperaturnya, semakin intensif pula gerak partikel-partikel tersebut.
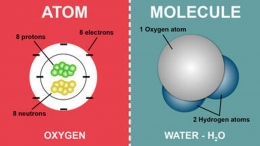
Partikel-partikel sebagian besar zat adalah molekul-molekul. Molekul adalah partikel terkecil dari suatu zat yang memiliki sifat kimianya. Molekul, pada gilirannya, terdiri dari atom. Atom adalah partikel terkecil dari suatu unsur yang memiliki sifat kimianya. Molekul bisa terdiri dari sejumlah atom yang berbeda.
Contohnya, molekul gas mulia adalah monoatomik, molekul zat seperti Hidrogen dan Nitrogen adalah diatomik, molekul air adalah triatomik, dll.
Molekul-molekul zat yang paling kompleks, misalnya protein dan asam nukleat, dibentuk oleh ratusan ribu atom.
Atom-atom bisa bergabung satu sama lain tidak hanya dalam proporsi yang berbeda, tetapi juga dengan cara yang berbeda. Oleh karena itu, walaupun jumlah unsur kimia relatif sedikit, namun jumlah zat yang berbeda sangat banyak.
Para siswa sering tidak bisa dengan segera memahami mengapa molekul zat tertentu tidak memiliki sifat fisikanya. Untuk memperjelas hal ini, mari kita perhatikan beberapa sifat fisika zat, misalnya titik leleh dan titik didih, kapasitas panas, kekuatan mekanik, kekerasan, densitas, dan konduktansi listrik.
Sifat-sifat seperti titik leleh dan titik didih, kekuatan mekanik, dan kekerasan ditentukan oleh kekuatan ikatan antara molekul-molekul dalam zat tertentu dalam keadaan agregasi tertentu. Oleh karena itu, penerapan konsep semacam itu pada molekul individual tidak masuk akal.
Sebaliknya, densitas adalah sifat yang mencirikan molekul individual dan bisa dihitung. Akan tetapi densitas suatu molekul selalu lebih besar daripada suatu zat (bahkan dalam keadaan padat) karena selalu ada ruang bebas di antara molekul-molekul dalam zat apapun.
Sifat-sifat seperti konduktansi listrik dan kapasitas panas tidak ditentukan oleh sifat-sifat molekul-molekul, tetapi oleh struktur suatu zat secara keseluruhan. Untuk meyakinkan diri kita sendiri bahwa ini benar, cukup diingat bahwa sifat-sifat ini berubah cukup besar dengan perubahan keadaan agregasi suatu zat, sedangkan molekul tidak mengalami perubahan yang besar.
Dengan demikian, wajar jika konsep beberapa sifat fisika tidak bisa diaplikasikan pada molekul individual, sedangkan sifat-sifat lainnya bisa, tetapi sifat-sifat ini sendiri berbeda besarannya untuk suatu molekul dan suatu zat secara keseluruhan.
Partikel-partikel yang membentuk suatu zat tidak selalu berupa molekul-molekul. Banyak zat dalam keadaan cair dan padat, misalnya sebagian besar garam, memiliki struktur ionik, bukan struktur molekuler, sedangkan beberapa zat lain memiliki struktur atom.
Kepustakaan:
1. N.L. Glinka, General Chemistry, Vol. 1, 3rd ed., 2nd printing, Leib, G (Transl.), MIR Publishers, Moscow, 1986.
2. Diary Johan Japardi.
3. Berbagai sumber daring.
Jonggol, 19 Agustus 2021
Johan Japardi
Follow Instagram @kompasianacom juga Tiktok @kompasiana biar nggak ketinggalan event seru komunitas dan tips dapat cuan dari Kompasiana
Baca juga cerita inspiratif langsung dari smartphone kamu dengan bergabung di WhatsApp Channel Kompasiana di SINI