Beberapa hari yang lalu, kebetulan saya mendapatkan kesempatan untuk menghadiri Annual Conference International Society for Pharmaceutical Engineering (ISPE), sebuah organisasi internasional perindustrian farmasi se-Indonesia di Jakarta.
Dalam konferensi tahunan ini, kebetulan issue yang menjadi fokus utama adalah mengenai mutu atau kualitas. Baik itu mutu yang berkaitan dengan fasilitas produksi beserta seluruh bahan (material), peralatan dan perlengkapan yang digunakan, mutu proses pembuatan, hingga mutu produk akhir (finished good).
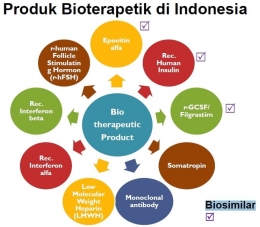
Dan salah satu topik yang menurut saya paling menarik dan sesuai dengan tren perkembangan produk di dunia industri farmasi adalah mengenai Produk Biosimilar. Topik ini disampaikan oleh perwakilan Badan Pengawas Obat dan Makanan (BPOM) RI sehingga fokus pembahasannya berpusat pada regulasi produk biosimilar di Indonesia.
Tren produk biosimilar sebenarnya sudah muncul sejak beberapa tahun yang lalu, namun karena kompleksitas dalam pembuatannya, hingga kini belum terlalu banyak produk biosimilar yang beredar di Indonesia.
Apa itu Produk Biosimilar?
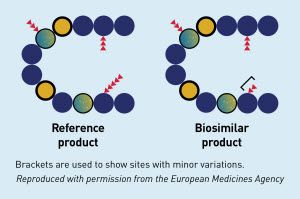
Menurut peraturan Kepala BPOM nomor 17 tahun 2015 tentang Pedoman Penilaian Produk Biosimilar, definisi Produk Biosimilar atau Similar Biotherapeutic Product (SPB) atau Produk Biologi Sejenis (PBS) adalah produk biologi dengan profil khasiat, keamanan, dan mutu yang similar/serupa dengan produk biologi yang telah disetujui.
Dan yang termasuk dalam Produk Biologi adalah vaksin, imunosera, antigen, hormon, enzim, produk darah dan produk hasil fermentasi lainnya (termasuk antibodi monoklonal dan produk yang berasal dari teknologi DNA rekombinan).
Oleh sebab itu tentunya ilmu Bioteknologi akan menjadi salah satu cabang ilmu yang terus berkembang karena ikut memberi andil dalam penyediaan Produk Biologi untuk kepentingan terapi, preventif (pencegahan) dan penatalaksanaan penyakit keganasan.
Produk Biologi ini biasanya digunakan untuk mengobati penyakit-penyakit serius seperti, Multiple Sclerosis, penyakit genetik yang jarang, anemia dan defisiensi hormon pertumbuhan.
Jika dilihat dari definisinya, status Produk Biosimilar sebenarnya mirip dengan dengan obat copy atau obat generik karena diproduksi setelah masa paten obat originatornya habis.
Produk originator adalah produk (obat) yang dikembangkan untuk pertama kalinya oleh suatu produsen dan terdaftar berdasarkan data lengkap mutu, keamanan dan efikasi (khasiat) serta memiliki hak paten. Hak paten suatu produk originator biasanya berlangsung selama 20 tahun.