0,3515 = 0,15 gram / mr x 1000 /10 gram
Mr = BM = 8534
- % kesalahan = | BM perhitungan -- BM teoritis | x 100% / BM teoritis
- % kesalahan = |8534 -- 122,12| x 100% / 122,12
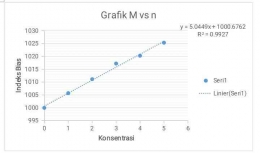
% kesalahan = 68,88 % - grafik hubungan antar n dan M
 Input sumber gambar
Input sumber gambar
Pembahasan
Secara praktikum percobaan yang dilakukan yaitu titik beku yang terjadi dapat dilihat berdasarkan kesetimbangan yang terjadi pada larutan. Dan didapat sesuai dengan hasil yang tercantum diatas bahwa Pada tekanan 1 atm, air membeku pada suhu 0 karena pada suhu itu tekanan uap air sama dengan tekanan uap es. Keberadaan zat terlarutdalam suatu larutan menyebabkan terjadinya penurunan tekanan uap jenuh pelarutnya dalam larutan tersebut dan hal ini menyebabkan titik beku berkurang. Jika saat zat terarutnya merupakan zat non elektrolit, maka penurunan titik bekunya sama dengan molalitas larutan (m). Titik beku pelarut murni lebih tinggi dari pada titik beku larutan. Penambahan zat terlarut dalam pelarut akan mengakibatkan peningkatan konsentrasi yang mengakibatkan semakin rendah titik bekunya. Jadi, semakin besar molalitas larutan, makin tinggi kenaikan titik didih larutan, dan membuat semakin tinggi penurunan titik bekunya. Jumlah partikel yang lebih banyak, akan membuat larutan elektrolit sukar membeku sehingga membutuhkan suhu yang lebih rendah (Amiliana at all .,2021).
Baca konten-konten menarik Kompasiana langsung dari smartphone kamu. Follow channel WhatsApp Kompasiana sekarang di sini: https://whatsapp.com/channel/0029VaYjYaL4Spk7WflFYJ2H