Reaksi Eksoterm dan Reaksi Endoterm
Setelah mempelajari tentang perubahan entalpi, selanjutnya kita akan mempelajari jenis reaksi berdasarkan perubahan energinya. Dalam hukum Termodinamika, benda yang memiliki perbedaan suhu mengalami perpindahan kalor secara spontan. Sedangkan dalam termokimia, terdapat dua kemungkinan terjadinya perbedaan suhu, yaitu suhu sistem yang lebih tinggi atau suhu sistem yang lebih rendah dari suhu lingkungan.
- Eksoterm
Apa yang terjadi apabila suhu sistem lebih tinggi dari suhu lingkungan? Perhatikan ilustrasi berikut.

Apabila suhu sistem lebih tinggi maka akan terjadi aliran kalor dari sistem menuju lingkungan yang ditunjukkan melalui anak panah di atas, dengan kata lain kalor akan keluar menuju lingkungan. Inilah yang disebut dengan proses eksoterm. Lalu, bagaimana besarnya perubahan entalpi dalam keadaan ini? Oleh karena sistem dikeluarkan menuju lingkungan, maka entalpi akhir reaksi akan menjadi lebih kecil dibandingkan dengan entalpi awal sebelum reaksi. Dengan demikian besarnya perubahan entalpi dituliskan melalui persamaan berikut.

- Endoterm
Apa yang terjadi apabila suhu sistem lebih rendah dari suhu lingkungan? Perhatikan ilustrasi berikut.
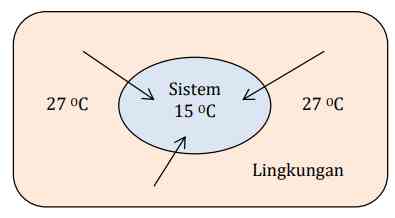
Apabila suhu sistem lebih rendah maka akan terjadi aliran kalor dari lingkungan menuju sistem yang ditunjukkan melalui anak panah di atas, dengan kata lain kalor masuk menuju sistem. Inilah yang disebut proses endoterm. Oleh karena kalor masuk menuju sistem, maka kalor sistem bertambah sehingga entalpi akhir reaksi akan menjadi lebih besar dibandingkan dengan entalpi awal sebelum reaksi.

Persamaan Termokimia

























