Dalam lingkungan rumah tangga, penggunaan gas elpiji sebagai bahan bakar untuk memasak sudah menjadi tidak asing lagi. Namun pernahkah Anda berpikir, senyawa apa yang terkandung dalam tabung gas tersebut?
Tabung gas elpiji mengandung senyawa karbon paling sederhana yang disebut senyawa hidrokarbon. Hidrokarbon merupakan sejenis senyawa yang banyak terdapat di alam sebagai minyak bumi. Artikel ini akan mengajak Anda untuk mengenal senyawa hidrokarbon mulai dari pengertian, struktur, penggolongan, hingga reaksi senyawa hidrokarbon.
Apa itu senyawa hidrokarbon?
Senyawa hidrokarbon adalah senyawa yang tersusun atas atom karbon (C) dan atom hidrogen (H) yang menjadi unsur utamanya. Atom karbon bergabung untuk membentuk suatu kerangka senyawa, selanjutnya atom hidrogen menempel dalam berbagai konfigurasi yang berbeda (CxHy).
Sesuai dengan nomor golongannya yaitu IVA, atom karbon memiliki 4 elektron valensi sehingga untuk mencapai konfigurasi yang sesuai dengan aturan oktet maka atom karbon memiliki kemampuan untuk membentuk empat ikatan kovalen yang relatif kuat baik tunggal, rangkap dua, dan rangkap tiga. Atom karbon dapat membentuk ikatan dengan atom karbon lain sehingga membentuk rantai karbon yang terbuka, bercabang, dan tertutup.
Bagaimana struktur atom karbon?
Berdasarkan kemampuan atom karbon yang dapat berikatan dengan atom karbon lain, jenis atom karbon dapat dikelompokkan menjadi empat, yaitu atom karbon primer, sekunder, tersier, dan kuartener. Istilah ini muncul berdasarkan jumlah atom karbon yang terikat pada karbon tertentu.
a. Atom Karbon Primer
Atom karbon primer atau atom C primer adalah atom-atom C yang mengikat satu atom C yang lain.
b. Atom Karbon Sekunder
Atom karbon sekunder atau atom C sekunder adalah atom-atom C yang mengikat dua atom C yang lain.
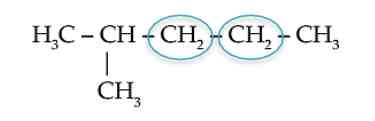
c. Atom Karbon Tersier
Atom karbon tersier atau atom C tersier adalah atom-atom C yang mengikat tiga atom C yang lain.
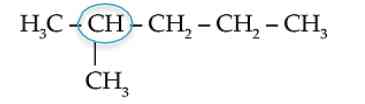
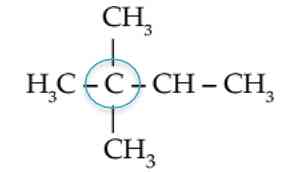
d. Atom Karbon Kuartener
Atom karbon kuartener atau atom C kuartener adalah atom-atom C yang mengikat empat atom C yang lain.
Penggolongan Senyawa Hidrokarbon
Senyawa hidrokarbon terdiri dari senyawa hidrokarbon alifatik (rantai lurus) dan senyawa hidrokarbon siklik. Senyawa hidrokarbon alifatik terdiri dari senyawa hidrokarbon alkana (CnH2n+2), alkena (CnH2n) dan alkuna (CnH2n-2).
a. Alkana
1. Pengertian dan Rumus Alkana
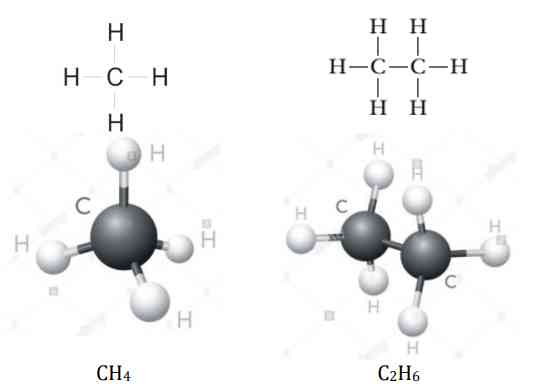
Alkana merupakan hidrokarbon jenuh dengan rantai karbon paling sederhana. Rumus umum senyawa alkana adalah (CnH2n+2) yang disebut juga parafin. Pada senyawa alkana, suku pertama sampai suku kesepuluh dapat peroleh dengan cara substitusi, yang mana n merupakan bilangan asli dan juga merupakan jumlah atom C yang ada. Sehingga, apabila atom C ada 1, maka atom H pada senyawa alkananya adalah 2(1) +2, yakni 4 buah sehingga rumus molekulnya adalah CH4. Apabila atom C ada 2, maka atom H pada senyawa alkananya adalah 2(2) +2, yakni 6 buah. Dengan demikian, rumus alkana dapat dituliskan menjadi C2H6, dan penjabarannya sebagai berikut.
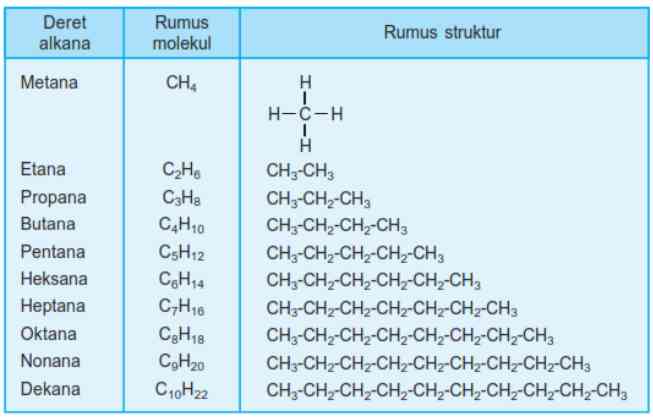
2. Tata Nama Alkana
a) Alkana Rantai Lurus
Tata nama alkana rantai lurus diawali dengan menuliskan n (n = normal). Contoh:
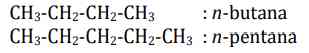
1) Rantai induk diambil dari rantai karbon terpanjang kemudian dicari namanya pada suku pertama pertama sampai suku kesepuluh dari senyawa alkana dan diletakkan di bagian belakang.
2) Satu atau beberapa atom hidrogen diganti menggunakan pecahan alkana (gugus alkil) sehingga penulisannya merupakan turunan dari penamaan alkana rantai lurus. Pecahan alkana ini disebut gugus alkil, biasa diberi tanda -R (dari kata radikal), dan mempunyai rumus umum -CnH2n+1. Nilai n merupakan jumlah atom karbon pada senyawa tersebut dan suku-sukunya dapat dilihat sebagai berikut.
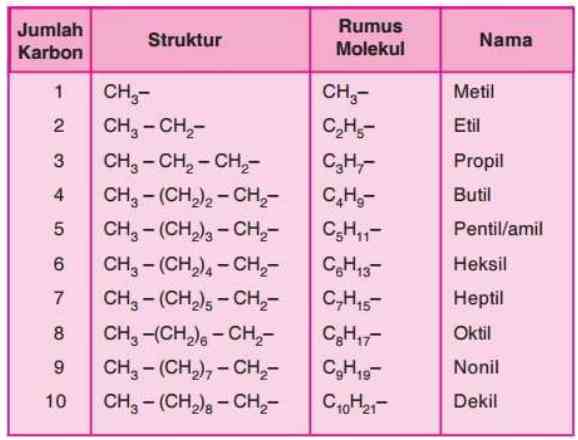
- Rantai cabang diberi nomor sekecil mungkin apabila hanya terdapat satu cabang
- Awalan Yunani (di = 2, tri = 3, tetra = 4, dan seterusnya) digunakan apabila alkil lebih dari satu dan sejenis, namun jika berbeda jenis penulisan dapat diurutkan sesuai alfabetis
c) Urutan Penamaan Senyawa Alkana:
- Nomor alkil/cabang
- Nama alkil/cabang
- Nama rantai utama
Contoh 1:
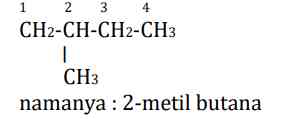
- Rantai induknya terdiri dari empat atom C namanya butana
- Penomoran dimulai dari ujung yang paling dekat dengan cabang, yaitu dari kiri
- Cabang terletak pada nomor 2
- Cabang diberi nama metil yang merupakan alkil yang terdiri dari satu atom C, sehingga penamaannya menjad 2-metil butana.
Contoh 2:

- Rantai induknya terdiri dari empat atom C, namanya butana
- Penomoran dapat dimulai dari ujung kanan atau kiri
- Cabang terletak pada nomor 2, dan 3
- Nama cabangnya metil, jumlah cabang ada dua (di beri awalan: di), sehingga namanya: 2,3-dimetilbutana
3. Ciri-ciri Alkana
a) Tidak memiliki ikatan rangkap (disebut hidrokarbon jenuh) dan terdiri dari rantai lurus dan alkana berbentuk siklo/cincin.
b) Disebut golongan parafin karena afinitasnya kecil
c) Sukar bereaksi
d) Suhu (T) dan tekanan (P) normal pada alkana C1 – C4 berwujud gas
e) Suhu (T) dan tekanan (P) normal pada alkana C4 – C17 pada T dan P berwujud cair
f) Alkana dengan rantai karbon > C18 pada T dan P normal berwujud padat
g) Semakin tinggi rantai karbon maka semakin tinggi titik didih
h) Pada jumlah atom C sama, alkana yang bercabang mempunyai titik didih rendah.
i) Mudah larut dalam pelarut non polar
j) Berat jenisnaik dengan penambahan jumlah unsur C
k) Sumber utama gas alam dan petroleum.
4. Isomer Alkana
Suatu senyawa yang mempunyai rumus molekul sama tetapi rumus struktur berbeda disebut isomer. Contoh: isomer C4H10 antara n-butana dengan metil propana.
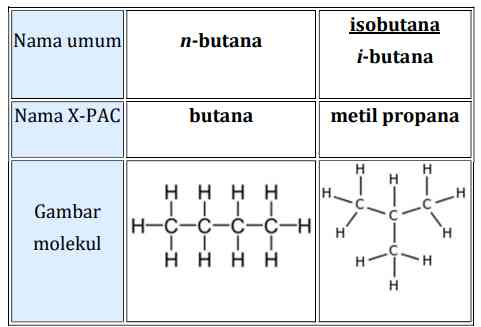
Isomer mempengaruhi perbedaan sifat dari masing-masing senyawa, yang mana:
1) Butana memiliki ciri-ciri: densitas 2,48 kg/m3 (pada 15 °C1 atm), titik lebur −138.4° C dan titik didih −0.5 °C.
2) Metil propana memiliki ciri-ciri: densitas 0,523 g/cm³ (pada 15 °C 1 atm), titik lebur −159 °C dan titik didih 11,7o C.
b. Alkena
1. Pengertian dan Rumus Alkena
Alkena merupakan hidrokarbon tidak jenuh yang mengandung ikatan rangkap dua pada rantai karbonnya (-C=C-). Alkena disebut rantai karbon tidak jenuh karena tidak mempunyai jumlah maksimum atom yang ditampung oleh setiap atom karbon. Rumus umum alkena adalah CnH2n. Bila jumlah atom C = 2, maka jumlah atom H = 2 x 2 = 4, rumus molekulnya C2H4. Mengapa tidak ada alkena dengan rumus molekul C =1?
Pada alkena harus terdapat satu ikatan rangkap dua antar atom C, sehingga alkena yang paling sederhana yaitu etena (C2H4). Alkena memiliki ikatan sigma dan ikatan phi antara dua atom karbon yang saling berhadapan.
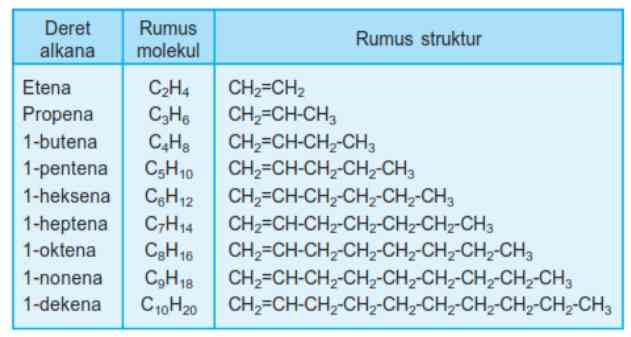
2. Tata Nama Alkena
1) Alkena Rantai Lurus
a) Jenis ikatan diperiksa, jika memiliki rangkap dua maka termasuk senyawa alkena
b) Jumlah atom C dihitung
c) Awalan ditulis berdasarkan jumlah atom C-nya dan diakhiri kata -ena
d) Jika jumlah atom lebih dari 3, pada setiap atom diberi nomor sehingga nomor terkecil terletak pada atom C yang terikat pada ikatan rangkap dua. Selanjutnya, penamaan senyawa diawali dengan nomor atom C pertama yang terikat pada ikatan rangkap 2, yang kemudian diikuti dengan tanda (-) dan nama rantai induk.
2) Alkena Rantai Bercabang
a) Rantai induk dan rantai cabang ditentukan, yang mana rantai induk dari atom C terpanjang yang mengandung ikatan rangkap dua
b) Pada setiap atom diberi nomor sehingga nomor terkecil terletak pada atom C yang terikat pada ikatan rangkap dua
c) Rantai induk diberi nama sesuai aturan penamaan alkena rantai lurus
d) Rantai cabang diberi nama sesuai jumlah atom C dan struktur gugus alkil
e) Urutan penulisan nama senyawa alkena sama dengan penamaan senyawa alkana.
3) Alkena yang Memiliki Ikatan Rangkap Dua Lebih dari Satu
a) Hitung jumlah atom C
b) Hitung jumlah ikatan rangkap dua
c) Jumlah ikatan rangkap = 2 diakhiri dengan -diena
d) Jumlah ikatan rangkap = 3 diakhiri dengan -triena
e) Pada setiap atom diberi nomor sehingga nomor terkecil terletak pada atom C yang terikat pada ikatan rangkap dua. Selanjutnya, penamaan senyawa diawali dengan nomor atom C pertama dan kedua/ketiga yang terikat pada ikatan rangkap 2, yang kemudian diikuti dengan tanda (-) dan nama rantai induk.
f) Jika terdapat rantai cabang, penamaan rantai cabang seperti penamaan senyawa alkena.
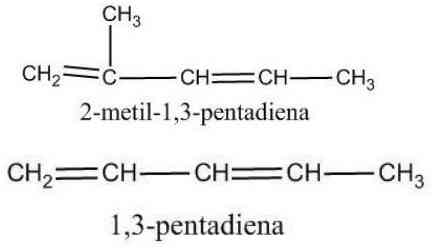
a) Isomer Bangun
Isomer bangun dimiliki oleh semua alkena yang memiliki 4 atau lebih atom karbon, sehingga terdapat dua atau lebih rumus bangun yang bisa dibuat untuk masing-masing rumus molekul. Contoh C4H8
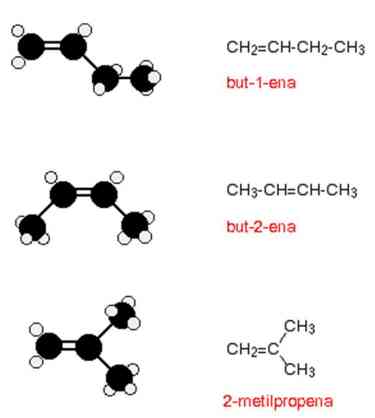
Ikatan karbon-karbon rangkap (C=C) tidak memungkinkan mengalami rotasi dalam strukturnya. Sehingga, gugus-gugus CH3 yang terdapat pada kedua ujung molekul dapat dikunci pada posisinya baik pada salah satu molekul atau dua sisi yang berlawanan. Apabila gugus-gugus berprioritas lebih tinggi (nomor atom lebih besar) berada pada satu sisi disebut sebagai cis-2-butena dan apabila gugus-gugus berprioritas lebih tinggi (nomor atom lebih besar) berada pada dua sisi yang berlawanan disebut trans-2-butena.
4. Sifat Alkena
a) Titik Didih
Titik didih alkena sedikit lebih rendah dibanding dengan titik didih alkana dengan jumlah atom yang sama.
b) Kelarutan
Alkena hampir tidak larut dalam air, namun larut dalam pelarut organik, seperti lemak dan minyak.
c) Reaktifitas
Sifat-sifat ikatan kimia dalam senyawa etena mengandung ikatan karbon rangkap dua (C=C) berlaku pada ikatan C=C dalam alkena yang lebih kompleks.
Ikatan rangkap antara atom karbon disebut juga dua pasang elektron bersama. Salah satu dari pasangan elektron dipegang pada sebuah garis lurus antara dua inti karbon, namun pasangan lainnya dipegang dalam sebuah orbital molekul yang terdapat di atas dan di bawah bidang molekul tersebut. Orbital molekul adalah kebolehjadian tertinggi ditemukannya sepasang elektron.
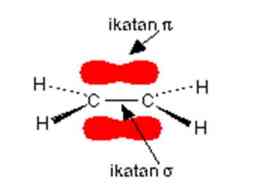
Ikatan pi adalah pasangan elektron lain yang ditemukan di suatu tempat dalam bagian berarsir di atas atau di bawah bidang molekul. Elektron pi tidak sepenuhnya dikendalikan oleh inti karbon seperti pada elektron dalam ikatan sigma. Selain itu, karena elektron pi terletak di atas dan di bawah daerah kosong dari molekul, maka elektron-elektron ini relatif terbuka untuk diserang oleh lain.
5. Reaksi-Reaksi Pada alkena
a) Reaksi Adisi
Pada reaksi adisi, ikatan pi terputus dan elektron-elektron dari ikatan digunakan untuk menggabungkan dua atom karbon dengan yang lainnya.
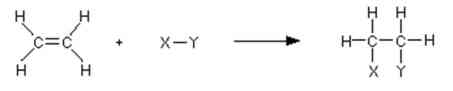
Beberapa jenis reaksi adisi:
- Adisi hidrogen dan halogen (hidrogenasi dan halogenasi)
- Adisi halide hidrogen (hidrohaleganasi)
- Adisi H2SO4 dan H2O
c. Alkuna
1. Pengertian dan Rumus alkuna
Alkuna merupakan deret senyawa hidrokarbon tidak jenuh yang mengandung satu ikatan rangkap tiga diantara dua atom C yang berurutan. Untuk membentuk ikatan rangkap tiga diperlukan 6 elektron, sehingga tersisa satu elektron pada tiap-tiap atom C untuk mengikat atom H. Jumlah atom H yang dapat diikat berkurang dua, sehingga rumus umumnya menjadi CnH2n+2 – 4H à CnH2n-2
Apabila jumlah atom C = 2, maka jumlah atom H = (2 x 2) - 2 = 2, sehingga rumus molekulnya adalah C2H2. Mengapa tidak ada alkuna dengan rumus molekul C =1? Karena pada alkuna harus terdapat satu ikatan rangkap tiga antar atom C sehingga alkuna yang paling sederhana adalah etuna (C2H2).
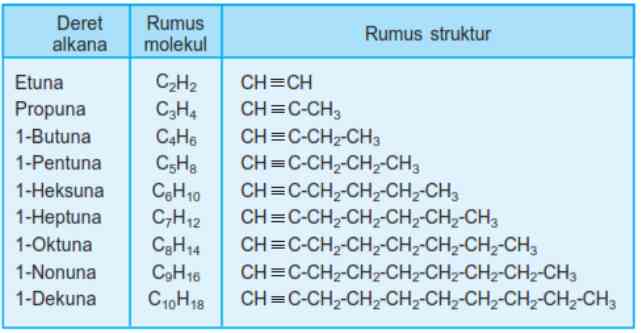
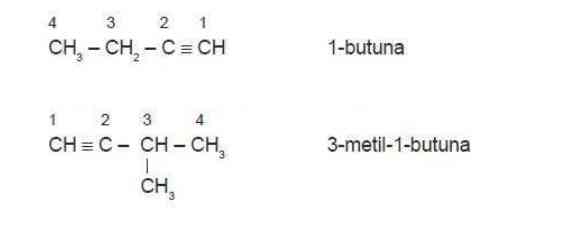
2. Tata nama alkuna
Tata nama alkuna sama dengan alkana maupun alkena, yang mana bagian pertama menunjuk pada jumlah atom karbon, sedangkan bagian kedua adalah akhiran -una, namun suku pertamanya juga memiliki n = 2 seperti alkena.
3. Sifat-sifat Alkuna
- Senyawa endoterm yang mudah meledak
- Berbentuk gas, tidak berwarna, dan baunya khas
- Asetilena adalah gas terpanas dan terefisien dari semua gas bahan bakar. Asetilena memiliki panas yang tinggi dengan sisa pembakaran minimal dan membutuhkan oksigen dalam jumlah sedikit untuk melakukan pembakaran sempurna.
- Asetilena bersifat lebih ringan dari udara sehingga tidak menyebabkan bahaya ledakan.
4. Penamaan Alkuna
1) Senyawa Alkuna
a) Jenis ikatan diperiksa, jika memiliki ikatan rangkap tiga maka merupakan senyawa alkuna.
b) Jumlah atom C dihitung.
c) Awalan dituliskan berdasarkan jumlah atom C-nya dan diakhiri dengan kata -una.
d) Jika jumlah atom C lebih dari tiga, maka setiap atom diberi nomor sehingga nomor paling kecil terletak pada atom C yang terikatan dengan ikatan rangkap tiga. Selanjutnya, penamaan senaywa diawali oleh nomor atom C pertama yang terikat pada ikatan rangkap tiga, diikuti tanda (-) dan nama rantai induk.
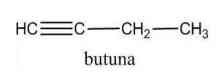
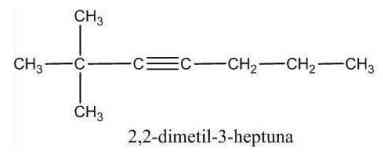
a) Jenis ikatan diperiksa, jika memiliki ikatan rangkap tiga maka merupakan senyawa alkuna.
b) Rantai induk dan rantai cabang ditentukan.
c) Setiap atom diberi nomor sehingga nomor paling kecil terletak pada atom C yang terikat pada rangkap tiga.
d) Rantai induk diberi nama sesuai penamaan alkuna rantai lurus.
e) Rantai cabang diberi nama sesuai jumlah atom C dan struktur gugus alkil.
f) Urutan penulisan nama senyawa sama dengan penamaan senyawa alkana dan alkena.
Follow Instagram @kompasianacom juga Tiktok @kompasiana biar nggak ketinggalan event seru komunitas dan tips dapat cuan dari Kompasiana
Baca juga cerita inspiratif langsung dari smartphone kamu dengan bergabung di WhatsApp Channel Kompasiana di SINI


























