* Distilasi adalah suatu cara pemisahan larutan dengan menggunakan panas sebagai pemisah atau "separating agent". Jika larutan yang terdiri dari dua buah komponen yang cukup mudah menguap, misalnya larutan benzena-toluena, larutan n-Heptan dan n-Heksan dan larutan lain yang sejenis didihkan, maka fase uap yang terbentuk akan mengandung komponen yang lebih menguap dalam jumlah yang relatif lebih banyak dibandingkan dengan fase cair.
Jadi ada perbedaan komposisi antara fase cair dan fase uap, dan hal ini merupakan syarat utama supaya pemisahan dengan distilasi dapat dilakukan. Kalau komposisi fase uap sama dengan komposisi fase cair, maka pemisahan dengan jalan distilasi tidak dapat dilakukan.
Dasar pemisahan pada destilasi adalah perbedaan titik didih komponen cairan yang dipisahkan pada tekanan tertentu. Penguapan diferensial dari suatu campuran cairan merupakan bagian terpenting dalam proses pemisahan dengan destilasi, diikuti dengan penampungan material uap dengan cara pendinginan dan pengembunan dalam kondensor pendingin-air.
Mempelajari proses pemisahan dengan teknik destilasi mesti dipahami bahwa semua molekul dalam fasa cair memilika dinamika pergerakan yang konstan. Pembangkitan tekanan internal dan kecenderungan molekul lepas dari permukaan dalam bentuk uap, tergantung pada karakteristik cairan. Tekanan uap adalah ukuran kecenderungan terlepasnya molekul dari permukaan cairan, tekanan uap cairan adalah sifat dari cairan itu dan tidak tergantung pada komposisi fasa uap. Peningkatan temperatur akan meningkatkan pergerakan molekul fasa cair sehingga mempercepat proses terlepasnya molekul.
* Volatilitas adalah kecenderungan suatu zat untuk menguap. Zat yang mudah menguap memiliki kemampuan untuk masuk ke fase uap. Hal ini dapat terjadi selama pemanasan atau tanpa pemanasan. Volatilitas dan tekanan uap suatu zat saling berhubungan. Jika volatilitasnya tinggi maka tekanan uapnya juga tinggi. Sebaliknya, jika volatilitasnya rendah, maka tekanan uapnya pun rendah. Biasanya cairan bersifat mudah menguap. Mereka cenderung masuk ke fase uap dengan cepat. Misalnya aseton, heksana, kloroform adalah cairan yang mudah menguap dan cepat menguap. Apalagi ada beberapa padatan yang bisa langsung masuk ke fasa uap tanpa melalui fasa cair.
Zat non volatil adalah zat yang tidak dapat menguap dengan cepat. Mereka tidak memiliki tekanan uap yang lebih tinggi pada suhu dan tekanan ruangan normal. Selain itu, zat yang tidak mudah menguap sebagian besar akan berbentuk padat pada suhu ruangan. Misalnya natrium klorida, perak nitrat merupakan senyawa yang tidak mudah menguap. Terlebih lagi, ketika senyawa nonvolatil bercampur dengan cairan yang mudah menguap seperti air, senyawa tersebut mudah dipisahkan melalui penguapan. Kemudian cairan yang mudah menguap akan menguap meninggalkan padatan yang tidak mudah menguap di dasar wadah.
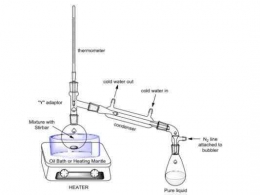
BERIKUT RANGKAIAN ALAT DESTILASI
PENENTUAN KOEFISIEN DISTRIBUSI DAN PERSEN EKSTRAKSI
* Menurut Soebagio (2002:34), menurut hukum distribusi Nerst, bila ke dalam kedua pelarut yang tidak saling bercampur dimasukkan solut yang dapat larut dalam kedua pelarut tersebut maka akan terjadi pembagian kelarutan. Kedua pelarut tersebut umumnya pelarut organik dan air. Dalam praktek solut akan terdistribusi dengan sendirinya ke dalam dua pelarut tersebut setelah di kocok dan dibiarkan terpisah. Perbandingan konsentrasi solut di dalam kedua pelarut tersebut tetap, dan merupakan suatu tetapan pada suhu tetap. Tetapan tersebut disebut tetapan distribusi atau koefisien distribusi. Koefisien distribusi dinyatakan dengan berbagai rumus sebagai berikut :
KD = atau KD =
dari rumus tersebut jika harga KD besar, solute secara kuantitatif akan cenderung terdistribusi lebih banyak ke dalam pelarut organik begitu pula sebaliknya. Rumus tersebut hanya berlaku bila:
a. Solute tidak terionisasi dalam salah satu pelarut
b. Solute tidak berasosiasi dalam salah satu pelarut
c. Zat terlarut tidak dapar bereaksi dengan salah satu pelarut atau adanya reaksi- reaksi lain.
* Menurut Pudjaatmaka (2002:312-213). Hukum distribusi merupakan hukum pembagian jumlah molekul menurut tingkatan energinya atau secara umum distribusi adalah jumlah cara untuk merealisasikan pembagian (distribution law). Tujuan ekstraksi yaitu untuk menarik atau memisahkan senyawa dari simplisia atau campurannya. Pemilihan metode dilakukan dengan memperhatikan senyawa, pelarut yang digunakan serta alat yang tersedia. Metode ekstraksi yang umum digunakan adalah maserasi dan refluks (Hanani, 2017).