Pada artikel sebelumnya kita sudah belajar mengenai reaksi penetralan asam-basa yang menghasilkan garam dan air. Nah! Materi tersebut berhubungan dengan hidrolisis garam yang akan kita bahas hari ini. Hidrolisis terbentuk dari kata hidro yang artinya air dan lisis artinya penguraian. Sehingga, hidrolisis merupakan suatu reaksi penguraian garam dan air yang menghasilkan anion dan kation dimana Ketika bereaksi dengan air membentuk asam hydronium dan basa hidroksida. Reaksi hidrolisis berlawanan dengan reaksi penetralan. Ketika garam terionisasi di dalam air Adapun kemungkinan reaksi hidrolisis yang terjadi yaitu:
- Kation dari garam bereaksi dengan air menghasilkan ion H+ menyebabkan larutan bersifat asam H+ > OH-
- Anion dari garam bereaksi dengan air menghasilkan ion OH- menyebabkan larutan bersifat basa OH->H+
- Kation dan anion tidak bereaksi dengan air sehingga [H+] dan [OH-] tidak berubah larutan bersifat netral
Ion-ion tersebut jika bereaksi dengan air ditandai dengan menghasilkan asam lemah atau basa lemah. Garam-garam yang dihasilkan dilihat dari kekuatan asam-basa pembentuknya. Adapun jenis-jenis garam sebagai berikut:
- Garam basa (asam lemah dan basa kuat)
Anion dari reaksi tersebut menghasilkan OH- dan larutan bersifat basa. Contoh
Akibat adanya OH-, konsentrasi H+ dalam air lebih sedikit. Hanya ion CH3COO- yang terhidrolisis sedangkan Na+ tidak bereaksi dengan air. Hidrolisis ini disebut sebagai hidrolisis parsial atau sebagian dan bersifat basa dengan pH >7. Adapun rumus untuk mencari konsentrasi anion [OH-] sebagai berikut
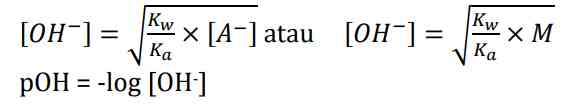
Kemudian derajat ionisasi dari garam basa dapat dicari dengan
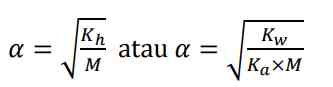
- Garam asam (asam kuat dan basa lemah)
Kation dari reaksi tersebut menghasilkan ion H+ dan larutan bersifat asam

Akibat adanya ion H+, konsentrasi OH- dalam air lebih sedikit. Hanya ion NH4+ yang mengalami hidrolisis sedangkan ion Cl- tidak bereaksi dengan air. Hidrolisis ini disebut sebagai hidrolisis parsial atau sebagian dan bersifat asam dengan pH <7 Adapun rumus untuk mencari konsentrasi H+
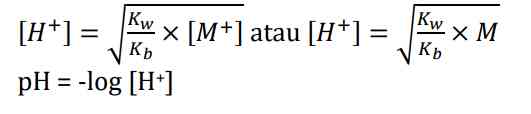
untuk mencari derajat ionisasi garam asam dapat dicari dengan:
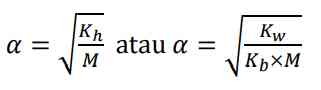
- Garam dari asam lemah dan basa lemah
Kedua ion dari garam dari asam lemah dan basa lemah dalam air terionisasi
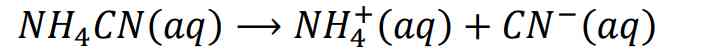
ion NH4+ terionisasi menjadi:
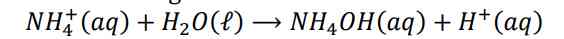
ion CN- terionisasi menjadi:
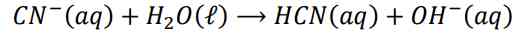
Hidrolisis dari garam asam lemah dan basa lemah merupakan hidrolisis total. Sifat larutan garamnya ditentukan oleh nilai tetapan kesetimbangan dari reaksi. Jika Ka>Kb maka larutan bersifat asam sedangkan jika Ka

Derajat ionisasi dari garam (asam lemah dan basa lemah) secara matematis dirumuskan:
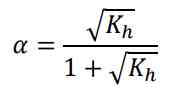
- Garam dari asam kuat dan basa kuat
Ion-ion dari garam asam kuat dan basa kuat tidak bereaksi dengan air sehingga segera terionisasi Kembali menjadi ion-ion semula. Sehingga konsentrasi H+ dan OH- dalam air tidak terganggu dan larutan bersifat netral dan memiliki nilai pH = 7
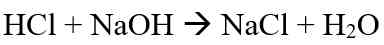
Follow Instagram @kompasianacom juga Tiktok @kompasiana biar nggak ketinggalan event seru komunitas dan tips dapat cuan dari Kompasiana. Baca juga cerita inspiratif langsung dari smartphone kamu dengan bergabung di WhatsApp Channel Kompasiana di SINI


















