Pada artikel sebelumny akita sudah belajar mengenai larutan asam-basa. Reaksi yang terjadi antara asam-basa disebut juga sebagai reaksi penetralan yang menghasilkan garam dan air. Contohnya reaksi antara asam klorida dengan natrium hidroksida menghasilkan natrium klorida dan air.
Pada reaksi antara asam dan basa dengan konsentrasi sama, tidak selalu menghasilkan larutan netral akibat pengaruh dari kekuatan asam dan basa. Sehingga, untuk menetralkan asam dengan basa dilakukan titrasi. Titrasi merupakan suatu aktivitas menambahkan larutan baku yang dikenal juga larutan yang telah diketahui konsentrasinya dengan bantuan indikator. Reaksi penetralan membantu dalam menentukan kadar atau konsentrasi suatu larutan. Kadar larutan asam dapat ditentukan dengan larutan basa yang telah diketahui kadarnya atau sebaliknya. Jadi dalam reaksi titrasi harus ada salah satu larutan yang telah diketahui konsentrasinya.
Alat-alat yang diperlukan untuk titrasi yaitu:
- Buret: sebagai tempat titrat atau larutan penetrasi
- Erlenmeyer: sebagai tempat titran atau larutan yang dititrasi
- Statif dan klem untuk menegakkan dan memegang buret
Adapun Langkah-langkah dalam melakukan titrasi yaitu sebagai berikut:
1. Larutan yang berperan sebagai penetrasi atau larutan yang akan diteteskan dimasukkan ke dalam buret.
2. Larutan yang akan dititrasi dimasukkan ke dalam Erlenmeyer dengan kondisi volume larutan telah terukur dengan baik
3. Indikator diteteskan ke larutan yang akan dititrasi dengan pipet tetes. Indikator yang biasanya digunakan pada titrasi asam-basa adalah fenolftalein atau PP, metil merah dan bromtimol biru
4. Kemudian dilakukan proses titrasi dengan mengatur keran buret untuk menetaskan larutan penetrasi secara perlahan dan Erlenmeyer digoyang-goyangkan . Penambahan larutan penetrasi dihentikan jika larutan berubah warna yang artinya titik akhir titrasi (TAT) sudah tercapai.
- Titik ekivalen Ketika jumlah mol H+ = jumlah mol OH- yang ditunjukkan dengan harga pH
- Titik akhir titrasi yaitu keadaan ketikan titrat berubah warna setelah diteteskan titran dan indikator
5. Volume yang dibutuhkan larutan penetrasi untuk mengubah warna titrat dicatat
Untuk menghitung kadar titrat dapat dilakukan dengan cara:
1. Menghitung volume rata-rata titran (jika percobaan titrasi dilakukan lebih dari satu kali)
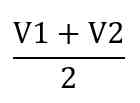
2. Menghitung konsentrasi (M) titrat dengan rumus:
- Va x Ma x val. Asam = Vb x Mb x val. Basa
- Dengan keterangan:
- Va/Vb = volume asam/basa
- Ma/Mb= konsentrasi asam/basa
- Val. Asam/basa = valensi asam/basa
Dalam titrasi asam-basa juga terdapat grafik titrasi asam-basa. Grafik titrasi menggambarkan alur pH terhadap volume asam atau basa yang ditambahkan Ketika titrasi. Dengan adanya grafik titrasi titik ekivalen dari reaksi asam-basa dapat dilihat. Terdapat tiga jenis grafik yaitu:
- Titrasi asam kuat oleh basa kuat
Dalam titrasi ini grafik menunjukkan titik ekivalen di pH = 7. Indikator yang dapat digunakan adalah metil merah, bromtimol biru atau fenolftalein (PP). namun, indikator PP lebih sering digunakan karena perubahan warnanya lebih mudah diamati
- Titrasi asam lemah oleh basa kuat
Dalam titrasi ini grafik menunjukkan titik ekivalen di atas pH 7 yaitu sekitar 8-9. Indikator yang dapat digunakan adalah fenolftalein.
- Titrasi basa lemah oleh asam kuat
Dalam titrasi ini grafik menunjukkan titik ekivalen dibawal pH 7 yaitu sekitar 5-6. Indikator yang dapat digunakan adalah metil merah
Follow Instagram @kompasianacom juga Tiktok @kompasiana biar nggak ketinggalan event seru komunitas dan tips dapat cuan dari Kompasiana. Baca juga cerita inspiratif langsung dari smartphone kamu dengan bergabung di WhatsApp Channel Kompasiana di SINI









