Pada artikel sebelumnya kita sudah membahas mengenai teori asam basa Nah! Pada artikel kali ini kita akan membahas mengenai larutan asam basa. Dalam larutan asam dan basa tentu ada zat terlarut dan pelarut. Pada kasus kali ini zat terlarutnya berupa asam atau basa dan pelarutnya adalah air. Air sering digunakan sebagai pelarut bahkan disebut sebagai pelarut universal yang memiliki sifat elektrolit lemah. Air disebut sebagai elektrolit lemah karena hanya Sebagian dari molekul air yang terionisasi menjadi ion H+ dan OH-
H2O(l) H+(aq) + OH-(aq)
Berdasarkan reaksi kesetimbangan air tersebut dapat dirumuskan ketetapan kesetimbangan air
K = [H+] [OH-]/[H2O]
K [H2O] = [H+] [OH-]
Akibat fraksi molekul air yang terionisasi sangat kecil, konsentrasi air hampir tidak berubah sehingga:
K [H2O] = Kw = [H+] [OH-]
Kw = [H+] [OH-]
Perbandingan ion H+ dan OH- dalam air murni (larutan netral) yaitu, [H+] = [OH-]
Kw = [H+] [H+]
Kw = [H+]^2
Pada suhu standar 25C, air murni memiliki Kw = 1 x 10^-14
Dimana [H+] = 1x10^-7 dan [OH-] = 1x10^-7
Penambahan ion H+ menyebabkan [H+] bertambah namun Kw tidak berubah sedangkan, penambahan ion OH- menyebabkan [OH-] bertambah namun Kw tidak. Untuk menentukan [H+] dan [OH-] sebagai berikut:
Asam yang terionisasi sempurna disebut sebagai asam kuat contohnya asam sulfat, asam bromide, asam iodide, asam klorat dan asam perklorat. Adapun rumus untuk menghitung [H+] sebagai berikut:
[H+] = Ma x a
Dengan keterangan :
[H+] = konsentrasi ion H+ (mol/L)
Ma = Molaritas asam kuat (mol/L)
a = valensi asam kuat
- Basa kuat
Basa yang terionisasi sempurna disebut sebagai basa kuat contohnya, litium hidroksida, natrium hidroksida, kalium hidroksida, kalsium hidroksida, rubidium hidroksida. Stronsium hidroksida, sesium hidroksisa, barium hidroksida, dan magnesium hidroksida. Adapun rumus untuk menghitung [OH-] sebagai berikut:
[OH-] = Mb x b
Dengan keterangan :
[OH-] = konsentrasi ion OH- (mol/L)
Mb = Molaritas basa kuat (mol/L)
b = valensi basa kuat
Asam yang terionisasi sebagaian dalam air disebut sebagai asam lemah. Sebagaian molekul asam yang terurai memiliki derahat ionisasi 0
Dengan keterangan:
[H+] = konsentrasi ion H+ (mol/L)
Ma = Molaritas asam lemah (mol/L)
alpha = derajat ionisasi asam lemah
- Basa lemah
Basa yang terionisasi sebagaian dalam air disebut sebagai basa lemah. Sebagaian molekul basa yang terurai memiliki derahat ionisasi 0
Adapun rumus untuk menghitung [OH-] dalam asam lemah yaitu:
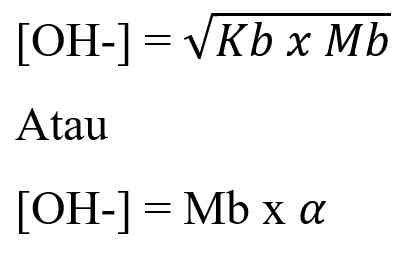
Dengan keterangan:
[OH-] = konsentrasi ion OH- (mol/L)
Mb = Molaritas basa kuat (mol/L)
alpha = derajat ionisasi basa lemah
Follow Instagram @kompasianacom juga Tiktok @kompasiana biar nggak ketinggalan event seru komunitas dan tips dapat cuan dari Kompasiana. Baca juga cerita inspiratif langsung dari smartphone kamu dengan bergabung di WhatsApp Channel Kompasiana di SINI








