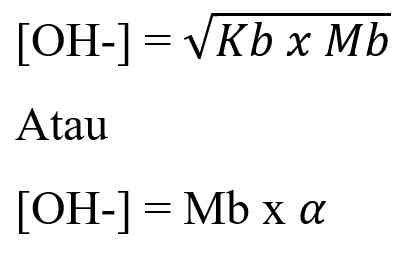Pada artikel sebelumnya kita sudah membahas mengenai teori asam basa Nah! Pada artikel kali ini kita akan membahas mengenai larutan asam basa. Dalam larutan asam dan basa tentu ada zat terlarut dan pelarut. Pada kasus kali ini zat terlarutnya berupa asam atau basa dan pelarutnya adalah air. Air sering digunakan sebagai pelarut bahkan disebut sebagai pelarut universal yang memiliki sifat elektrolit lemah. Air disebut sebagai elektrolit lemah karena hanya Sebagian dari molekul air yang terionisasi menjadi ion H+ dan OH-
H2O(l) H+(aq) + OH-(aq)
Berdasarkan reaksi kesetimbangan air tersebut dapat dirumuskan ketetapan kesetimbangan air
K = [H+] [OH-]/[H2O]
K [H2O] = [H+] [OH-]
Akibat fraksi molekul air yang terionisasi sangat kecil, konsentrasi air hampir tidak berubah sehingga:
K [H2O] = Kw = [H+] [OH-]
Kw = [H+] [OH-]
Perbandingan ion H+ dan OH- dalam air murni (larutan netral) yaitu, [H+] = [OH-]
Kw = [H+] [H+]
Kw = [H+]^2