Atom hydrogen merupakan suatu system yang sangat sederhana karena atom ini hanya memiliki satu elektron. Suatu elektron bisa berada di orbital 1s (keadaan dasar) atau berada di orbital yang energinya lebih tinggi (keadaan tereksitasi). Akan tetapi, untuk atom yang memiliki banyak elektron kita harus tau terkait konfigurasi elektron-nya. Dengan konfigurasi elektron ini kita akan mengetahui bagaimana elektron-elektron bisa tersebar di antara berbagai orbital atom sehingga kita bisa mengetahui perilaku elektronnya. Sebelum kita lanjut ke pembahasan selanjutnya, perlu diingat lagi bahwa jumlah elektron dalam atom sama dengan nomer atomnya.
Konfigurasi elektron merupakan susunan atau gambaran yang menunjukan tempat keberadaan elektron dalam suatu atom. Jadi, konfigurasi elektron ini nantinya akan menggambarkan susunan elektron-elektron dalam suatu atom.
Konfigurasi Elektron Berdasarkan Kulit Atom
Dalam hal ini, konfigurasi elektron untuk pengisian elektronnya dimulai dari tingkat energi (kulit) yang paling rendah, yaitu kulit K yang paling dekat dengan inti atom dan sebagai kulit pertama. Selanjutnya yaitu kulit L, setelah kulit L ada kulit M, dilanjutkan dengan kulit N. Saat pengisian elektron terhadap kulitnya, elektron diisi maksimum sesuai dengan batas kemampuan kulitnya, jika masih ada sisa elektron maka akan ditampung pada kulit selanjutnya. Untuk pengisian maksimal jumlah elektron dalam kulit yang ditempati, dapat dilihat pada tabel berikut ini.
Peraturan Penentuan Konfigurasi Elektron
Dalam menuliskan konfigurasi elektron, selain berdasarkan kulit atomnya, konfigurasi elektron juga ditulis dengan mengikuti beberapa aturan. Ada tiga aturan yang harus ditepati dalam menulis konfigurasi elektron, yaitu: Azas Aufbau, Aturan Hund, dan Prinsip Larangan Pauli.
Azas Aufbau
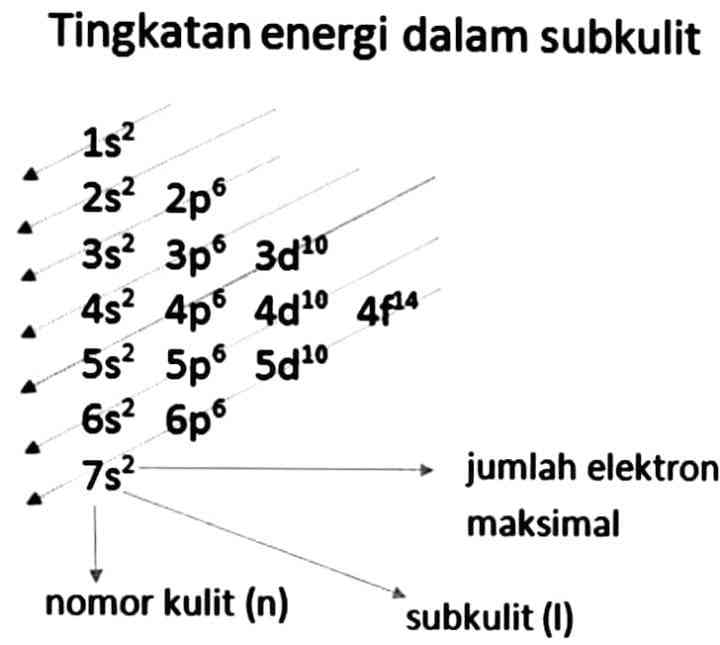
Pada Asas Aufbau ini dinyatakan pengisian elektron dimuali dari sub kulit yang tingkat energinya paling rendah. Berdasarkan gambar diatas "urutan tingkat energi sub kulit dari yang terendah, mengikuti arah anak panah yang dibaca mulai dari sudut kiri atas, yaitu
1s, 2s, 2p,...". Konfigurasi elektronnya dibuat dengan menuliskan lambang sub kulit yang kemudian diikuti dengan jumlah elektron yang dituliskan di sebelah kanan atas dari lambang sub kulit.

Sama halnya dalam konfigurasi elektron berdasarkan kulit atom, konfigurasi Aufbau ini juga memiliki pengisian maksimal jumlah elektron dalam sub kulitnya, yaitu: s= 2, p=6, d=10, f=14
Dengan adanya prinsip Aufbau ini dalam pengisian elektron, kita bisa menentukan konfigurasi elektron pada keadaan dasar untuk semua unsur berdasarkan posisi dalam tabel periodic dan nomer atomnya.
Aturan Hund
Aturan Hund menuliskan konfigurasi elektron dengan orbital-orbital, yang digambarkan dengan kotak berisi anak panah keatas dan ke bawah. Dalam pengisian orbital-orbital yang memiliki tingkat yang sama (setingkat) atau orbital dengan tingkat energi yang sama, Hund mengemukakan pendapatnya bahwa elektron-elektron tidak akan berpasangan sebelum masing-masing orbital terisi satu elektron dengan spin yang sama. Konfigurasi elektron dalam aturan Hund ini dituliskan dalam bentuk diagram orbital. Spin elektronnya digambarkan dengan anak panah, yaitu:
- Anak panah ke atas () untuk elektron dengan harga spin= +1/2
- Anak panah ke bawah () untuk elektron dengan harga spin= -1/2
-
 Contoh penulisan Elektron Aturan Hund
Contoh penulisan Elektron Aturan Hund
Prinsip Larangan Pauli
Pauli mengemukakan pendapatnya bahwa dalam suatu atom tidak ada dua buah elektron atau lebih, yang keempat bilangan kuantumnya mempunyai harga yang sama. Jika dua elektron dalam satu atom memiliki nilai bilangan kuantum yaitu, n, l, dan m nya sama (kedua elektron berada di orbital yang sama), maka kedua elektron itu harus memiliki nilai spin yang berbeda. Singkatnya, hanya ada 2 elektron bisa menempati orbital atom yang sama, dan kedua elektron itu harus punya spin yang berlawanan.
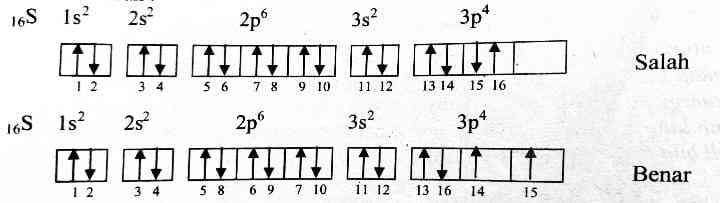
Note: Selain 3 aturan penulisan konfigurasi elektron tersebut, ada aturan lain yang menyatakan:
Tingkat energi pada sub kulit "d" dengan sub kulit "s" terdekat dan sub kulit "f" dengan sub kulit "s" terdekat mempunyai energi yang hampir sama, sehingga orbital lebih stabil jika terisi setengah penuh atau penuh.
Baca konten-konten menarik Kompasiana langsung dari smartphone kamu. Follow channel WhatsApp Kompasiana sekarang di sini: https://whatsapp.com/channel/0029VaYjYaL4Spk7WflFYJ2H










