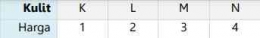
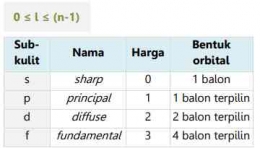
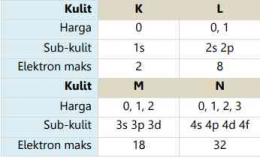
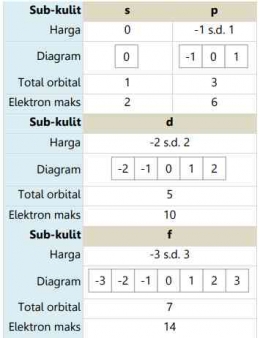
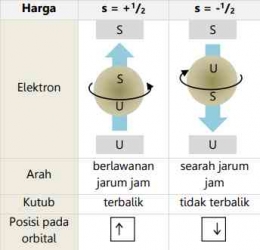
Saat elektron berputar di sekitar inti, ternyata ia juga berputar di sekitar sumbu/ porosnya. Putaran terhadap sumbu ini disebut rotasi. Elektron hanya dapat berputar dalam dua arah: searah jarum jam dan berlawanan arah jarum jam. Dua arah yang berbeda diwakili oleh bilangan kuantum spin (s) dengan nilai s = + artinya rotasi searah dengan arah putar jarum jam dan s = - artinya rotasi tidak searah putaran arah jarum jam. Digunakan nilai setengah karena hanya ada dua peluang orientasi, yaitu atas dan bawah. Dengan demikian, peluang untuk mengarah ke atas adalah 50% dan peluang untuk ke bawah adalah 50%.
Akibatnya, orbital hanya dapat ditempati oleh paling banyak dua elektron, dan dua elektron harus memiliki spin yang berlawanan dan menghasilkan medan magnet yang berlawanan. Medan magnet yang berlawanan ini diperlukan untuk mengimbangi tolakan listrik yang ada (karena muatan yang serupa).
Berikut ini merupakan tabel terkait bilangan kuantum spin:

Contoh:

Baca konten-konten menarik Kompasiana langsung dari smartphone kamu. Follow channel WhatsApp Kompasiana sekarang di sini: https://whatsapp.com/channel/0029VaYjYaL4Spk7WflFYJ2H