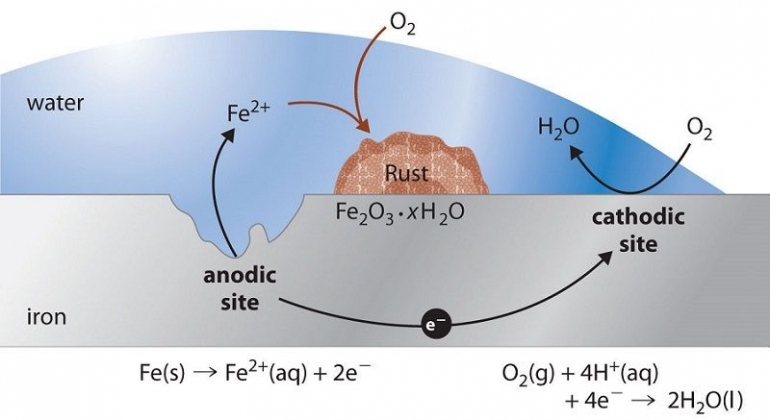
Oleh karenanya, perlu ada cara-cara yang lebih sederhana, mudah, dan murah yang bisa dilakukan untuk bisa mencegah korosi. Sebenarnya beberapa metode pencegahan sederhana sudah ditemukan dan digunakan secara luas.
Misalnya, dengan mengecat besi, memberikan oli dan gemuk, atau melapisi besi dengan logam lain (contohnya, pelapisan logam timah pada kaleng). Semua metode ini dilakukan dengan tujuan mencegah terjadinya interaksi besi dengan oksigen dan molekul air.
Pencegahan korosi dengan meniadakan interaksi besi dengan oksigen dan molekul air bisa kita kategorikan sebagai metode-metode fisis yang bisa kita lakukan. Selain metode fisis, pencegahan korosi juga bisa dilakukan dengan metode kimiawi.
Metode kimiawi dilakukan dengan cara mencegah terjadinya oksidasi pada besi meskipun besi berinteraksi dengan oksigen dan molekul air. Sebenarnya, membuat paduan logam bisa juga kita kategorikan ke dalam metode ini.
Ada beberapa metode kimiawi yang lebih mudah dilakukan. Salah satu metode yang sering dilakukan adalah galvanisasi. Galvanisasi adalah proses pelapisan besi dengan zink (seng). Pelapisan ini memiliki fungsi hampir mirip dengan pelapisan timah pada kaleng, dimana besi terlindungi dari interaksi dengan oksigen dan molekul air.
Namun, galvanisasi tidak hanya melindungi besi dengan cara fisis, ada proses kimianya juga, yang disebut dengan perlindungan katoda (cathodic protection). Perlindungan katoda terjadi karena zink memiliki potensial reduksi yang lebih negatif dibandingkan besi. Hal ini menyebabkan zink akan mengalami oksidasi di anoda menggantikan besi. Sehingga besi akan terlindungi dengan menjadi katoda yang mengalami reduksi.
Prinsip perlindungan katoda ini juga digunakan pada proses pelapisan kromium (chromium plating) untuk mendapatkan lapisan perlindungan karat yang mengilap sehingga lebih indah estetikanya.
Metode lain yang sering digunakan adalah pengorbanan anoda (sacrificial protection). Prinsipnya sama dengan prinsip perlindungan katoda dimana digunakan logam lain yang memiliki potensial reduksi lebih negatif dibandingkan besi.
Cara ini dilakukan dengan menghubungkan besi dengan logam yang lebih negatif potensial reduksinya itu dengan sebuah kawat. Ketika proses elektrokimia terjadi, logam besi akan tereduksi sehingga aman dari korosi. Di sisi kawat lain, logam yang menjadi anoda akan teroksidasi dan lama-kelamaan akan mengikis habis. Proses ini seolah membiarkan anoda teroksidasi dan terkikis. Hal inilah yang membuat metode ini diberi nama pengorbanan anoda.
Dengan berjalannya waktu, logam di anoda yang rusak bisa digantikan dengan yang baru sehingga proses perlindungan katoda masih tetap bisa berlangsung. Proses pergantian inilah yang membedakan metode ini dengan metode perlindungan katoda biasa. Metode ini banyak digunakan untuk melindungi korosi pada kapal laut dan pipa besi yang ditanam di dalam tanah.
Sebuah Refleksi
Meskipun peristiwa korosi besi adalah peristiwa yang terlihat merugikan, tetapi ada banyak hikmah yang bisa kita dapatkan dari adanya proses ini. Korosi besi menyebabkan diri kita ditantang untuk lebih banyak berpikir alternatif cara untuk mencegahnya.
Beri Komentar
Belum ada komentar. Jadilah yang pertama untuk memberikan komentar!