Yang masuk jurusan IPA pasti ingat bahasan asam basa. Sekali lagi "ingat " ya bukan paham hehehe, ga hina kok kalo ngaku ga ngerti pas bahasan ini karena memang lumayan bikin kepala tuing-tuing.
Asam basa sebenarnya sudah dikenal semenjak zaman dahulu kala. Asam dicomot dari bahasa Latin yaitu acetum yang artinya cuka. Sementara basa (alkali) diambil dari bahasa arab yang artinya abu.
Seperti halnya segala hal di bumi ini yang selalu berpasangan, ada siang ada malam,ada hitam ada putih,aku yang nulis kamu yang baca, ada asam ada basa. Kedua zat ini memiliki sifat berlawanan.
Secara fisik asam dikenal lewat rasanya yang memang terasa asam di lidah dan korosif alias mampu merusak logam. Sementara basa berasa agak pahit dan licin seperti sabun .
Tapi jangan coba-coba dicicipi ya bisa bahaya. Kasus penyiraman air keras yang mampu merusak wajah membuktikan betapa berbahayanya asam. Ada cara lain untuk mengecek asam atau basa.
Nah, kita coba kupas asam basa berdasarkan 3 teori
Pertama Teori Bronsted Lowry
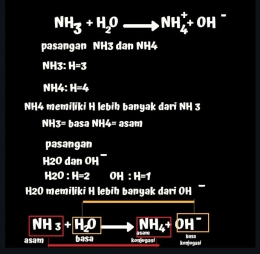
Kata Mbah Bronsted, asam adalah senyawa yang memiliki H lebih banyak dari pada basa,atau asam itu senyawa yang kaya dengan H.
Karena H identik dengan proton,jadi kalau zat itu asam maka dia akan memberikan protonnya atau dikenal dengan donor proton
Sementara Basa adalah senyawa yang memiliki H lebih sedikit atau lebih miskin H dari asam. Karena dia kekurangan proton maka dia akan menerima proton dari asam atau akseptor proton.
Bronsted lowry mengisyaratkan bahwa asam dan basa dalam suatu reaksi akan menjadi pasangan jika kedua zatnya mirip.
Konon kata orang dulu kalau mirip itu artinya jodoh,bener ga sih?
Nah, kemudian selisih asam dan basa H-nya 1 saja. Cara menentukan pasangan asam basa bronsted lowry adalah seperti berikut:

Kedua teori Asam basa lewis
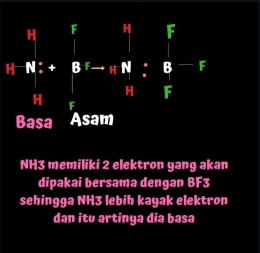
Jika bronsted lowry membahas proton maka Lewis membicarakan elektron. Suatu zat di katakan asam jika dia meminta elektron sementara basa kebalikannya punya banyak elektron dan siap memberikan elektronnya
Misalkan NH3 akan berikatan dengan BF3. NH3 masih memiiki sepasang elektron.
Jika BF3 datang meminang dalam keadaan miskin elekteon,maka NH3 akan menyumbangkan elektronnya demi keberlangsungan hubungan mereka berdua halah.
Tapi ingat ya itu elekton nya NH3 bukan elektron gono-gini yang nanti akan diperbutkan saat mereka bercerai!
Berikut ilustrasi Lewis antara NH3 dan BF3

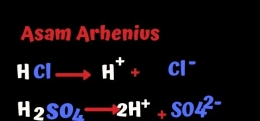
Menurut Arrhenius asam adalah zat yang jika dilarutkan akan terionisasi dan melepaskan H+conton asam misal HCl, H2SO4. Ini dia reaksi ionisasinya: Adda.


Suatu zat disebut asam jika setelah kita coba cek dengan mencelupkan lakmus biru ke dalam larutan tersebut, ternyata warna lakmus berubah menjadi merah.
Namun jika kita menggunakan lakmus merah saat pencelupan, tak ada perubahan warna, tetap lakmusnya berwarna merah.

Namun jika kita menggunakan lakmus biru saat pencelupan, tak ada perubahan warna tetap biru.

pH kewanitaan adalah bla..bla..bla.
Nah, derajat keasaman asam atau pHnya itu kurang dari 7, sementara basa memilii pH lebih dari 7.
Kalau kita mencoba buah jeruk, pasti kadang kita mendapatkan yang kecut, atau sedikit kecut. Kecut banget itu menunjukkan kalo keasamannya kuat. So, asam itu ada kategori asam kuat dan asam lemah.
Asam kuat diantaranya asam klorida (HCl),asam Bromisa (HBr),asam sulfat (H2SO4), asam Iodida HI dan asam nitrat (HNO3)
Sementara asam lemah diantaranya asam asetat (CH3COOH) atau biasa kita kenal dengan asam cuka. Penggemar kuliner bakso biasanya penggila asam cuka. Ga afdol kalo kuah baso ga manis,asem pedas katanya.
Begitupun dengan basa, ada yang dikategorikan basa kuat dan ada yang dikelompokkan jadi basa lemah.
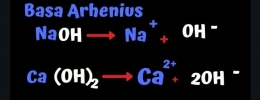
Basa kuat diantaranya Natrium hidoroksida (NaOH), Kalium hidroksida (KOH), barium hidroksida Ba(OH)2 dan kalsium hidroksida (Ca(OH)2).
Sementara itu basa lemah salah satu contohnya adalah amonium hidroksida atau NH4OH.
Itu dia sekilas bahasan asam basa. Asam dan basa bukan hal yang entah berantah,asam basa bisa kita temukan dalam kehidupan sehari.
Conton asam banyak banget dari asam jeruk sampai asam "ketek" yang baca tulisan ini.
Basa juga banyak di rumah. Bisa ditemukan dalam larutan pembersih atau sabun yang biasa kita gunakan.
Asam dan basa itu menetralkan. Itulah mengapa orang yang memiliki penyakit maag dianjurkan mengkonsumsi obat maag yang mengandung Mg(OH)2 yang kita kenal sebagai magnesium hidroksida. Tingginya asam lambung yaitu HCl akan dinetralkan oleh Mg(OH)2.
Baca konten-konten menarik Kompasiana langsung dari smartphone kamu. Follow channel WhatsApp Kompasiana sekarang di sini: https://whatsapp.com/channel/0029VaYjYaL4Spk7WflFYJ2H