Protein Terapetik dan Insulin Manusia
Protein terapetik merupakan suatu hasil dari rekayasa protein yang dirancang untuk memiliki aktivitas sebagai obat dandigunakan untuk keperluan klinis. Rancangan suatu protein terapetik terus terjadi dengan tujuan untuk meningkatkan potensi, efikasi, dan keamanan dari kinerja protein itu sendiri (Carter 2011). Salah satu contoh protein terapetik yang berkembang adalah insulin manusia.
Insulin manusia merupakan suatu hormon yang diproduksi di dalam sel beta dari sel endokrin di pankreas yang menghasilkan hormon dan bersifat penting dalam regulasi metabolisme glukosa. Hormon ini memiliki dua rantai, yaitu rantai asam amino A dan asam amino B, yang diikat oleh ikatan disulfida. Insulin manusia buatan berasal dari rekayasa genetika, di mana gen yang menghasilkan insulin manusia akan disisipkan pada suatu host bakteri untuk memproduksi insulinnya. Hal ini akan mempercepat produksi dan karakteristik insulinnya akan identik dengan insulin alami yang diproduksi oleh tubuh sehingga tidak menimbulkan reaksi-reaksi seperti alergi.
Fungsi dari insulin manusia adalah sebagai bahan terapi untuk pasien diabetes dari segala tipe. Kebutuhan insulin dapat berbeda-beda, tergantung pada tingkat sekresi insulin alami yang diproduksi oleh tubuh serta resistensi tubuh terhadap insulin. Jika pasien memiliki diabetes tipe 1, maka ia akan membutuhkan pengobatan insulin sepanjang hidupnya. Sedangkan untuk diabetes tipe 2, terapi insulin akan tetap dibutuhkan, namun tidak permanen dan masih dapat diselingi dengan diet, olahraga, pengurangan berat badan, dsb.(Migdalis 2011).
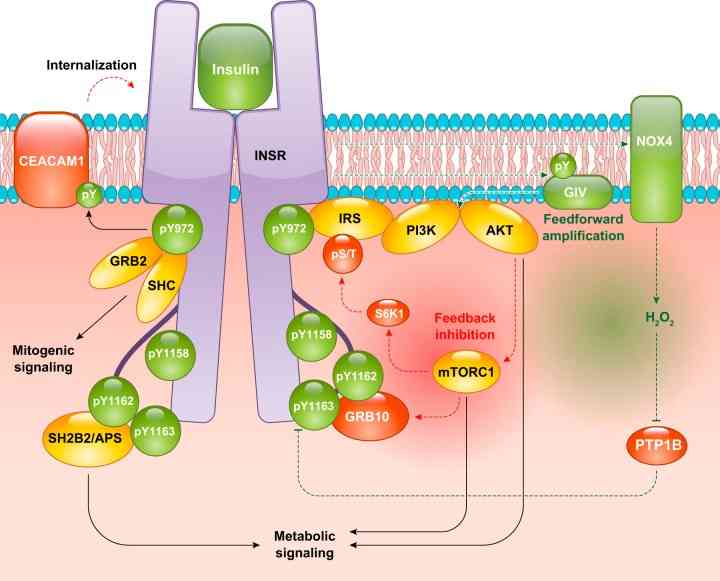
Insulin ini memiliki signaling pathway sebagai mekanisme kerjanya. Pertama, insulin akan berikatan dengan receptor INSR yang ada pada membran sel dan memicu adanya perubahan konformasi dari reseptor tersebut sehingga terjadi autofosforilasi atau ketambahan fosfat. Kemudian, hal ini membuat aktivasi dalam protein Insulin Receptor Substrate atau IRS yang akan berperan sebagai situs untuk signaling molekul. Kemudian, IRS ini akan mengaktifkan jalur pathway lainnya, yaitu PI3K dan menghasilkan suatu molekul yaitu PIP3. Molekul ini akan mengaktifkan serine atau threonine kinase atau protein kinase B yang meregulasikan metabolisme glukosa dalam tubuh.
Selain itu, IRS juga mengaktifkan MAPK pathway yang penting dalam proliferasi sel. Dari kedua pathway tersebut, AKT akan menstimulasikan GLUT4 yang penting dalam meningkatkan penyerapan kadar glukosa dalam sel. Selain itu, AKT juga mengaktivasi sintase glikogen dalam tubuh sehingga terjadilah sintesis glikogen. Lalu jika dilihat dari sisi lain, terdapat juga jalur feedback inhibition dari insulin signaling pathway ini yang bertujuan untuk menghindari adanya overstimulation dari metabolisme glukosa atau lainnya dengan cara didefosforilasi INSR-nya dan IRS-nya sehingga signaling berkurang (Petersen & Shulman 2018).
Produksi Protein Terapetik
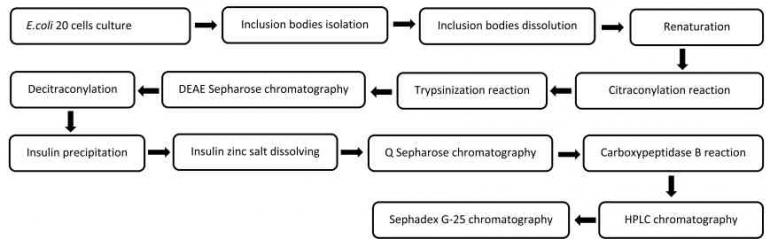
Produksi protein terapeutik, khususnya insulin rekombinan dari E. coli, melibatkan beberapa tahapan seperti pada (Gambar 2), proses dimulai dengan kultur sel E. coli yang berperan sebagai inang ekspresi insulin rekombinan. E. coli dipilih karena pertumbuhannya yang cepat dan kapasitasnya dalam memproduksi protein dalam jumlah besar, yang menjadikannya sistem ekspresi yang efisien dan ekonomis untuk produksi skala industri (Sharma et al. 2011). Setelah periode inkubasi, sel E. coli ini menghasilkan badan inklusi, yakni agregat protein yang berisi pro-insulin dalam bentuk tidak larut. Badan inklusi ini kemudian dipisahkan dari komponen seluler lainnya melalui sentrifugasi, yang merupakan tahap awal dalam proses pemurnian (Steiner et al. 2002). Namun, protein dalam badan inklusi ini berada dalam kondisi terdenaturasi dan tidak aktif secara biologis, sehingga memerlukan proses pelarutan untuk mengembalikan struktur aslinya.
Proses pelarutan dilakukan dengan menggunakan agen denaturasi kuat seperti urea atau guanidin hidroklorida untuk mengurai agregat protein dan membuatnya menjadi larut. Langkah ini diikuti oleh proses renaturasi yang sangat krusial, di mana protein harus dilipat kembali dengan benar ke dalam struktur tiga dimensi aktifnya. Tahap renaturasi ini membutuhkan pengaturan kondisi yang sangat tepat, termasuk pengontrolan pH, suhu, serta konsentrasi ion, untuk menghindari pembentukan kembali agregat protein yang akan merusak fungsinya. Jika kondisi ini tidak dijaga, protein akan cenderung menggumpal kembali dan kehilangan aktivitas biologisnya, sehingga gagal memenuhi fungsi terapeutiknya (Wang et al. 2013; Zielinski et al. 2019).
Setelah tahap renaturasi berhasil, protein terlarut ini kemudian melalui tahap pemurnian awal dengan menggunakan kromatografi DEAE Sepharose, sebuah metode kromatografi penukar anion yang memisahkan protein berdasarkan muatan permukaannya. Pada tahap ini, insulin prekursor dipisahkan dari kontaminan lain yang memiliki muatan berbeda (Strickland et al. 2008).
Selanjutnya, pro-insulin diolah melalui reaksi enzimatik dengan tripsin, yang bertugas memotong segmen tertentu dari protein untuk membentuk struktur yang lebih dekat dengan insulin. Proses ini diikuti dengan sitronilasi, yakni penambahan gugus sitronil untuk memodifikasi gugus amino yang dibutuhkan dalam pembentukan insulin yang lebih stabil secara kimiawi. Langkah berikutnya adalah melarutkan insulin dalam bentuk garam seng. Proses ini berfungsi untuk meningkatkan stabilitas protein sekaligus mempermudah proses pengendapan. Insulin kemudian diendapkan dengan menyesuaikan kondisi tertentu seperti pH atau konsentrasi ion, yang memisahkan insulin dari kontaminan terlarut lainnya, menghasilkan produk yang lebih murni (De Mey et al. 2007; Zielinski et al. 2019). Untuk menghilangkan pengotor tambahan, protein ini kemudian diproses menggunakan kromatografi Q Sepharose, yang merupakan teknik pemurnian lebih lanjut. Setelah itu, insulin mentah ini diolah kembali melalui reaksi enzimatik dengan karboksipeptidase B. Enzim ini menghilangkan residu asam amino terminal sehingga struktur akhir insulin menjadi sangat mirip dengan insulin manusia asli (Heinemann et al. 1995). Proses pemurnian dilanjutkan dengan kromatografi Sephadex G-25, yang memisahkan pengotor kecil berberat molekul rendah, dan tahap akhir menggunakan High-Performance Liquid Chromatography (HPLC). HPLC adalah metode kromatografi berpresisi tinggi yang memungkinkan pemisahan protein berdasarkan ukuran dan polaritasnya, menghasilkan produk insulin dengan kemurnian yang sangat tinggi (Liu et al. 2015).
Dengan kombinasi dari tahapan-tahapan pemurnian ini, insulin rekombinan yang dihasilkan memenuhi standar kualitas farmasi dan siap digunakan sebagai terapi bagi penderita diabetes. Proses ini menjamin bahwa insulin yang dihasilkan tidak hanya aktif secara biologis tetapi juga stabil dan aman untuk penggunaan klinis.
Pemanfaatan Teknik Rekombinan Untuk Pembuatan Insulin
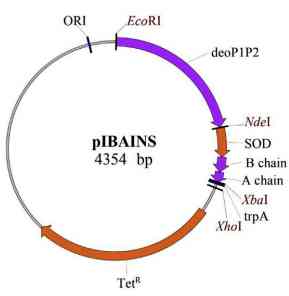
Untuk membuat insulin manusia, dibutuhkan teknik rekombinan yang dapat memproduksi insulin manusia dengan jumlah yang banyak, cepat, dan dengan harga yang terjangkau. Untuk rekombinan ini, dibutuhkan host kultur berupa Escherichia coli 20 strain IBA 1. Bakteri ini merupakan turunan dari Escherichia coli K-12 yang akan digunakan dalam proses transformasi. Jenis isolat ini digunakan sebagai host karena telah mengalami modifikasi, yaitu telah dihilangkan bagian proline-lactose operonnya. Hal ini bertujuan untuk meningkatkan efisiensi dalam menghemat energi bagi host serta mengurangi interfensi gen-gen lain dari operon sehingga ekspresi insulin yang diinginkan bisa lebih stabil. Kemudian, telah dimutasi juga bagian dari gen rpsL yang mengkoding resistensi streptomycin atau ribosomal protein S12. Hal ini bertujuan agar nantinya saat ditransformasi dengan vector plasmid, sel yang tidak mengandung plasmid tidak akan hidup karena tidak resisten terhadap streptomycin. Selain itu, dengan adanya resistensi streptomycin, akan memungkinkan sel host untuk "membutuhkan plasmid" sehingga tidak akan dibuang oleh dirinya. Selanjutnya, host ini juga telah dimodifikasi dengan cara bagian gen cytR yang berfungsi dalam regulator transkripsionalnya sudah dimutasi sehingga lebih baik dalam memproduksi human insulin karena dapat meningkatkan ekspresi gen. Kemudian, digunakan vektor plasmid juga berupa pIBAINS yang merupakan turunan dari plasmid pBR322 (Zielinski et al. 2019).
Kelebihan dan Kelemahan Insulin Manusia Buatan
Dahulu manusia memanen insulin dari pankreas babi dan sapi. Akan tetapi, proses untuk mengembangbiakan dan memelihara hewan memakan biaya yang besar dan membutuhkan waktu yang lama. Dengan mengandalkan mikroorganisme seperti E. coli produksi insulin dapat diproduksi dengan cepat. Tidak seperti hewan ternak, E. coli tidak membutuhkan lahan luas, pakan, hingga perawatan yanf relatif lebih mudah. Selain itu insulin rekombinan E. coli juga mampu mereplikasi 100% insulin manusia, insulin hewan ternak dapat menimbulkan alergi bagi beberapa individu (Allen et al. 2019; Baeshen et al. 2014; Fuquay et al. 2011). Akan tetapi, terkadang produksi insulin berbasis mikroorganisme seperti E. coli juga memiliki kekurangan. Kekurangan paling terlihat dari pemakaian E. coli untuk produksi insulin adalah adanya kemungkinan produksi insulin yang sedikit dan bahkan tidak ada sama sekali. Untuk menanggulangi hal tersebut perlu diperhatikan beberapa hal. Konsentrasi inducer atau senyawa yang dapat menginduksi produksinya insulin tersebut. Selain itu, proses pemurnian insulin dari E. coli juga cukup rumit sehingga biaya produksi dan waktu produksi dapat membengkak (Jayakrishnan et al. 2024).
Contoh Insulin Komersial
Pada tahun 1982, FDA melegalkan penjualan dan penggunaan insulin yang diproduksi dalam E. coli. Saat ini sudah tersedia berbagai produk insulin berbasis E. coli yang dapat dijumpai (Riggs 2020). Salah satu contoh insulin yang sudah diproduksi massal adalah berlinsulin oleh Bernie-Chernie. Beberapa tipe insulin lain seperti insulin lispro, insulin glargine, hingga insulin glulisine juga sudah diproduksi secara massal. Onset kerja dari insulin-insulin ini juga variatif tergantung pada formulasi pembuatanya (Siew & Zhang 2021).
Kesimpulan
Produksi insulin menggunakan teknik rekombinan merupakan teknik produksi insulin yang lebih canggih dan telah menjadi metode utama untuk memenuhi permintaan global untuk insulin. Hal ini membawa manfaat yang sangat banyak, terutama di tengah meningkatnya kasus diabetes. Proses produksi insulin dengan metode ini sering kali menggunakan bakteri E. coli sebagai sistem ekspresinya, dikarenakan pertumbuhannya yang cepat dan efisien. Namun, produksi insulin dari E. coli melibatkan langkah-langkah kompleks dalam pemurnian. Tantangan utama dalam metode ini adalah menyesuaikan setiap langkah agar menghasilkan insulin yang aman, efektif, dan dalam harga yang terjangkau bagi para pasien, terutama di negara-negara dengan akses terbatas terhadap insulin.
Daftar Pustaka
Allen D, Ruan CH, King B, Ruan KH. 2019. Recent advances and near future of insulin production and therapy. Future medical and chemistry. 11(13): 1513-1517. DOI: 10.4155/fmc-2019-0134.
Carter PJ. 2011. Introduction to current and future protein therapeutics: a protein engineering perspective. Experimental Cell Research. 317(1): 1261-1269.
De Mey M, Maertens J, Lequeux G, Soetaert W. 2007. Influence of zinc on insulin precipitation. Biotechnology and Bioengineering. 97(5): 1272-1279.
Fuquay JW, Fox PE, McSweeney PL. 2011. Encyclopedia of dairy science. Ed ke-2. Missisippi (US): Academic Press.
Heinemann L, Steiner S, Berger M. 1995. Carboxypeptidase B and its application in insulin production. Journal of Biological Chemistry. 270(36): 21112-21118.
Jayakrishnan A, Rosli WRW, Tahir ARM, Razak FSA, Kee PE, Ng HS, Chew YL, Lee SK, Ramasamy M, Tan CS, Liew KB. 2024. Evolving paradigms of recombinant protein production in pharmaceutical industry: a rigorous review. Sci. 6(1): 1-24. DOI: 10.3390.sci6010009.
Liu J, Zhang J, Chen Y. 2015. Advances in HPLC techniques for protein purification. Journal of Pharmaceutical Analysis. 5(6): 367-375.
Migdalis IN. 2011. Insulin analogs versus human insulin in type 2 diabetes. Diabetes Research and Clinical Practice. 93(1): 102-104.
Petersen MC, Shulman GI. 2018. Mechanisms of insulin action and insulin resistance. American Psychological Society. 98(4): 2133-2223.
Riggs A. 2020. Making, cloning, and the expression of human insulin genes in bacteria: the path to humulin. Endocrine review. 42(3): 374-380. DOI: 10.1210/endrev/bnaa029.
Sharma A, Ghosh M, Bhattacharya M. 2011. Recombinant protein production using Escherichia coli. Current Science. 101(4): 484-492.
Siew YY, Zhang W. 2021. Downstream processing of recombinant human insulin and its analogue production from E. coli inclusion bodies. Bioresour bioprocess. 8(1): 65. DOI: 10.1186/s40643-021-00419-w.
Steiner DF, Chan SJ, Welsh JM, Kwok SC. 2002. Structure and evolution of the insulin gene. Annual Review of Genetics. 19(1): 463-484.
Strickland SA, Purdy KE. 2008. Chromatographic methods for the separation of proteins. Journal of Chromatography A. 1217(25): 4056-4063.
Wang D, Li W, Xie M. 2013. Optimization of refolding conditions for recombinant proteins. Protein Expression and Purification. 90(1): 134-139.
Zielinski M, Chruscielewska AR, Mikiewicz D, Lukasiewicz N, Sokolowska I, Antosik J, Ruta AS, Krzysik AB, Zaleski P, Plucienniczak A. 2019. Expression and purification of recombinant human insulin from E. coli 20 strain. Protein Expression and Purification. 157(1): 63-69.
Baca konten-konten menarik Kompasiana langsung dari smartphone kamu. Follow channel WhatsApp Kompasiana sekarang di sini: https://whatsapp.com/channel/0029VaYjYaL4Spk7WflFYJ2H









