Heloo semuaa......
Untuk para pembaca yang setia, terimakasih sudah membaca setiap isi pembelajaran yang telah saya lampirkan.
Pertama saya akan memperkenal diri yaitu:
Nama : Ezra Roahanauli Sitinjak
NIM : 4223331016
Prodi : Pendidikan Kimia di UNIVERSITAS NEGERI MEDAN
Angkatan : 2022
Kelas : PSPK B
Tujuan saya dalam membuat artikel ini untuk memberikan pengertian baru kepada pembaca dan guna memenuhi tuhas praktikum. Saya adalah seorang praktikan pada mata kuliah Praktikum Kinetika Dan Kesetimbangan dari kelompok I (satu) yang berjudul "Penentuan Berat Molekul Berdasarkan Penurunan Titik Beku.
Kalian tahu gak apa itu berat molekul? Apa itu penurunan titik beku? Gimana sih konsep praktikumnya? Nah dari pertanyaan diatas akan terjawab melalui artikel yang saya buat. Mari dibaca dan diperhatikan setiap penejelasan yang akan saya berikan. Cas....ciss.....cussss......mari kita belajar bersama ezra.
Jenis campuran ada dua, yaitu campuran homogen dan campuran heterogen. Campuran antara dua zat yang bercampur secara homogen inilah yang disebut larutan. Salah satu sifat yang dimiliki larutan adalah sifat koligatif. Sifat koligatif larutan tidak bergantung pada jenis zat terlarut, tetapi hanya bergantung pada konsentrasi zat pelarut. Salah satu sifat koligatif adalah penurunan titik beku. Titik beku sendiri merupakan titik dimana suhu larutan menjadi setimbang dengan pelarut padatnya. Penurunan titik beku merupakan selisish antar titik beku pelarut dengan larutannya (Sukarjono.,2020).
Sifat -- sifat larutan sangat dipengaruhi oleh susunan komposisinya.Untuk menyatakan komposisi larutan maka digunakan istilah konsentrasi larutan yang menunjukkan perbandingan jumlah zat terlarut terhadap pelarut. Untuk jumlah zat terlarut berbeda setiap larutan, maka dibutuhkan energi panas yang berbeda pula, yang nantinya mempengaruhi titik didih larutan. Titik didih suatu larutan merupakan suhu larutan saat suhu tekanan uap jenuh larutan tersebut sama dengan tekanan udara luar (tekanan yang diberikan pada permukaan cairan)(Usman DKK.,2021).
Penurunan titik beku yang diakibatkan oleh satu mol partikel zat terlarut dalam satu kilogram pelarut disebut penurunan titik beku molal, yang digunakan sebagai tetapan untuk penentuan berat molekul zat terlarut. Penurunan titik beku larutan sebanding dengan jumlah partikel zat terlarut dalam sejumlah tertentu pelarut. Berdasarkan hal ini, dapat dikatakan bahwa penurunan titik beku yang disebabkan oleh satu mol zat non elektrolit adalah sama, tanpa memperhatikan jenis zat terlarutnya, selama jenis pelarutnya sama. Pengaplikasian penurunan titik beku terdapat pada proses Deicing. Deicing didefinisikan sebagai suatu proses menghilangkan akumulasi salju, embun beku, lumpur salju dan es dari suatu permukaan lapisan, celah atau engsel yang biasa terjadi pada pesawat terbang. Dari uraian diatas tujuan dilakukan percobaan ini agar dapat menentukan berat molekul zat terlarut dengan penurunan titik beku. Lalu untuk mengetahui hubungan antara berat molekul zat dengan penurunan titik beku. Dan juga untuk mengetahui hubungan antara penurunan titik beku dengan molalitas (Pratiwi.,2019).
Pada tekanan 1 atm, air membeku pada suhu 0 karena pada suhu itu tekanan uap air sama dengan tekanan uap es. Keberadaan zat terlarutdalam suatu larutan menyebabkan terjadinya penurunan tekanan uap jenuh pelarutnya dalam larutan tersebut dan hal ini menyebabkan titik beku berkurang. Jika saat zat terarutnya merupakan zat non elektrolit, maka penurunan titik bekunya sama dengan molalitas larutan (m). Titik beku pelarut murni lebih tinggi dari pada titik beku larutan. Penambahan zat terlarut dalam pelarut akan mengakibatkan peningkatan konsentrasi yang mengakibatkan semakin rendah titik bekunya. Jadi, semakin besar molalitas larutan, makin tinggi kenaikan titik didih larutan, dan membuat semakin tinggi penurunan titik bekunya. Jumlah partikel yang lebih banyak, akan membuat larutan elektrolit sukar membeku sehingga membutuhkan suhu yang lebih rendah (Amiliana at all .,2021).
Faktor-Faktor yang mempengaruhi Penurunan Titik Beku
- Berat jenis
Hubungan antara berat jenis dari larutan dengan penurunan titik beku yakni berbanding lurus. Artinya jika berat jenis larutan semakin besar maka penurunan titik beku semakin tinggi, begitu juga sebaliknya.
- Konsentrasi latutan
Semakin besar konsentrasi sebuah zat terlarut dalam sebuah larutan, maka akan semakin rendah titik beku larutan tersebut. Sedangkan jika konsentrasi sebuah zat terlarut dalam suatu larutan semakin kecil, maka titik beku larutan tersebut akan semakin tinggi
- Molalitas
Semakin besar molalitas sebuah larutan, maka nilai penurunan titik beku nya akan semakin tinggi. Sedangkan jika molalitas sebuah larutan semakin kecil, maka nilai penurunan titik bekunya akan semakin rendah pula ( Puspita.,2013).
Penjelasan diatas adalah sebagai pengertian awal dalam praktikum yang saya lakukan, maka dalam penentuan berat molekul berdasarkan penurunan titik beku, maka berikut adalah alat, bahan, dan prosedur yang saya gunakan yaitu:
- Alat- Alat Yang Digunakan Sebagai Berikut:
1. Termometer 100 C (1 buah)
2. Tabung Reaksi Besar (2 buah)
3. Pengaduk (2 buah)
4. Gelas Kimia 800 ml (1 buah)
5. Gelas Kimia 250 ml (2 buah)
6. Spatula (1 buah)
7. Kaca Arloji (1 buah)
8. pipet Tetes (2 Buah)
- Bahan Yang Digunakan
- Benzena (Cair, Tidak Berwarna, 20 ml)
- Asam Benzoat (Padat, Putih, 0,15 gram)
- Es balok (Padat, Tidak Berwarna, Secukupnya)
- Prosedur Kerja
- Disiapkan gelas kimia dan tabung reaksi besar lalu ditimbang.
- Dimasukkan 20ml benzena kedalam tabung reaksi besar yang sudah ditimbang dan ditimbang kembali.
- Dimasukkan tabung reaksi tersebut kedalam gelas kimia yang sudah berisi es batu, lalu diaduk cairan secara perlahan dan merata.
- Dicacat harga suhu setiap selang waktu 0,5 menit (30 detik). Percobaan dihentikan setelah 10 kali selang waktu 0,5 menit, maka diperoleh harga suhu yang tetap dan dirata-ratakan semua suhu yang diamati.
- Ditimbang 0,5 gram asam benzoat, kemudian dimasukkan kedalam pelarut murni benzena.
- Ditentukan titik beku larutan asam benzoat dengan cara percobaan 4, lalu dihitung perbedaan titik beku pelarut dan titik beku larutan.
Adapun reaksi yang didapat ketika asam benzoat ditambah benzena yaitu:
C6H6 + C7H6O2 C13H10 (aq) + 2H2O(l)
Hasil yang didapat kan dalam percobaan yang dilakukan yaitu:
- Berat tabung reaksi kosong (Benzena) = 40,22 gram
- Berat tabung + Benzena = 56,53 gram
- Maka didapat berat pelarut murni (benzena) = 56,63 g -- 40,22 g = 16,41 gram
- Berat tabung reaksi kosong (Asam benzoat) = 41,04 gram
- Berat tabung +Asam benzoat = 41,16 gram
- Maka didapat berat (asam benzoat) = 41,16 g -- 41,04 g = 0,1 gram
- Harga suhu yang didapatkan asam benzoat yaitu :
- 9, 6, 6, 6,6
- Harga suhu yang didapatkan benzena yaitu :
- 10, 8 8
Perhitungan :
- Dik : Tf pelarut murni (benzena) = 6,3
Tf larutan (benzena + asam benzoat) = 8,1
Dit : BM (Mr) Asam benzoat ?
Jawaban : Tp = Tf pelarut-Tf Larutan
Tp = 6,3 - 8,1
= -1,8- Tf= m x Kf
Kf benzena = -5,12
m= Tf / Kf
= -1,8-5,12 = 0,3515- gr asam benzoat /
m = gr / mr x 1000/
0,3515 = 0,15 gram / mr x 1000 /10 gram
Mr = BM = 8534
- % kesalahan = | BM perhitungan -- BM teoritis | x 100% / BM teoritis
- % kesalahan = |8534 -- 122,12| x 100% / 122,12
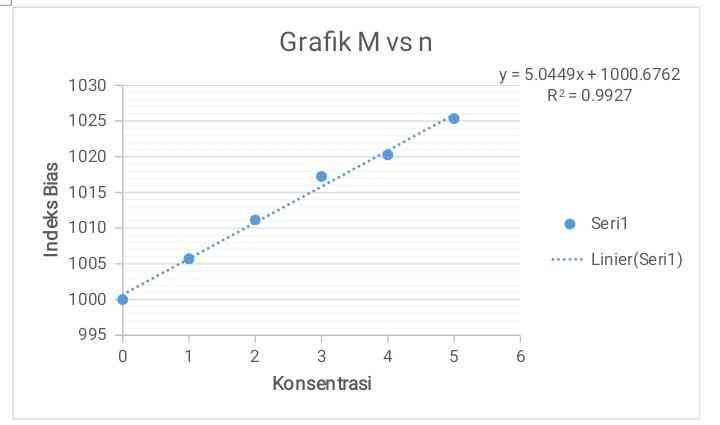
% kesalahan = 68,88 % - grafik hubungan antar n dan M
Pembahasan
Secara praktikum percobaan yang dilakukan yaitu titik beku yang terjadi dapat dilihat berdasarkan kesetimbangan yang terjadi pada larutan. Dan didapat sesuai dengan hasil yang tercantum diatas bahwa Pada tekanan 1 atm, air membeku pada suhu 0 karena pada suhu itu tekanan uap air sama dengan tekanan uap es. Keberadaan zat terlarutdalam suatu larutan menyebabkan terjadinya penurunan tekanan uap jenuh pelarutnya dalam larutan tersebut dan hal ini menyebabkan titik beku berkurang. Jika saat zat terarutnya merupakan zat non elektrolit, maka penurunan titik bekunya sama dengan molalitas larutan (m). Titik beku pelarut murni lebih tinggi dari pada titik beku larutan. Penambahan zat terlarut dalam pelarut akan mengakibatkan peningkatan konsentrasi yang mengakibatkan semakin rendah titik bekunya. Jadi, semakin besar molalitas larutan, makin tinggi kenaikan titik didih larutan, dan membuat semakin tinggi penurunan titik bekunya. Jumlah partikel yang lebih banyak, akan membuat larutan elektrolit sukar membeku sehingga membutuhkan suhu yang lebih rendah (Amiliana at all .,2021).
- Dik : Tf pelarut murni (benzena) = 6,3
Baca konten-konten menarik Kompasiana langsung dari smartphone kamu. Follow channel WhatsApp Kompasiana sekarang di sini: https://whatsapp.com/channel/0029VaYjYaL4Spk7WflFYJ2H