Ikatan kimia merupakan gaya tarik menarik yang kuat antara atom atau ion yang mengikat mereka dalam suatu struktur yang stabil. Memahami ikatan kimia sangatlah penting untuk mempelajari berbagai sifat dan perilaku zat dalam ilmu kimia. Beberapa teori telah dikembangkan untuk menjelaskan sifat ikatan kimia, di antaranya sebagai berikut.
1. Teori Orbital Molekul (TOM)
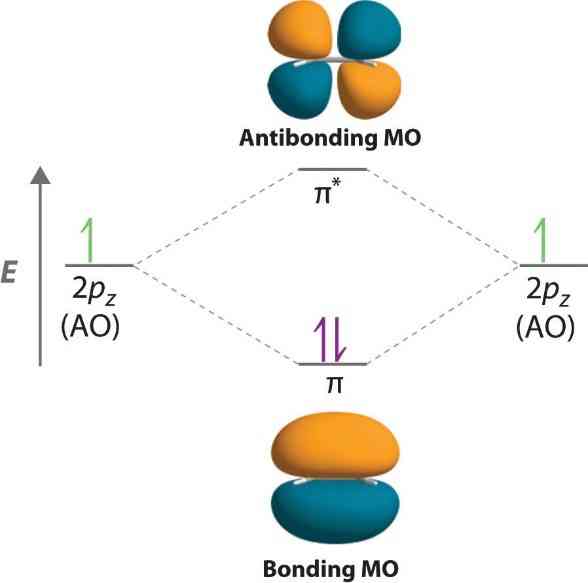
Teori Orbital Molekul (TOM) menjelaskan ikatan kimia berdasarkan kombinasi orbital atom untuk membentuk orbital molekul yang dapat menampung elektron. Orbital molekul terbentuk dari tumpang tindih orbital atom. Jenis tumpang tindih dan energi orbital molekul menentukan sifat ikatan kimia, seperti kekuatan ikatan, panjang ikatan, dan sifat magnetik. Terdapat dua jenis orbital molekul yaitu ikatan dan antiikatan, disajikan pada Gambar 1.
Gaya Van der Waals adalah gaya tarik menarik antar molekul yang lemah dan bersifat sementara. Gaya ini disebabkan oleh fluktuasi distribusi muatan elektron dalam molekul, yang menghasilkan momen dipol sementara. Momen dipol sementara pada satu molekul dapat menarik momen dipol sementara pada molekul lain, sehingga menghasilkan gaya tarik menarik. Kekuatan gaya Van der Waals tergantung pada ukuran dan polarisasi molekul. Terdapat tiga jenis gaya Van der Waals diantaranya gaya dipol-dipol, gaya ion-dipol dan gaya London. Lebih lanjut disajikan pada Tabel 1. berikut.
Tabel 1. Jenis-jenis gaya Van der Waals

Ikatan hidrogen adalah gaya tarik menarik yang kuat antara atom hidrogen yang terikat pada atom elektronegatif (seperti O, N, F) dengan atom elektronegatif lainnya. Ikatan hidrogen terbentuk karena adanya transfer parsial elektron dari atom hidrogen ke atom elektronegatif, sehingga atom hidrogen menjadi parsial positif dan atom elektronegatif menjadi parsial negatif. Gaya tarik menarik elektrostatis antara atom hidrogen parsial positif dan atom elektronegatif parsial negatif inilah yang disebut ikatan hidrogen. Contoh ikatan hydrogen pada H2O disajikan pada Gambar 2. berikut.

4. Ikatan Logam