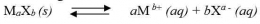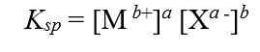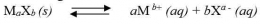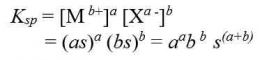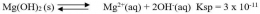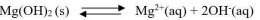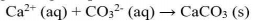Reaksi Pengendapan
Kita dapat mengeluarkan suatu ion dari larutannya melalui reaksi pengendapan. Misalnya ion kalsium (Ca2+) dapat dikeluarkan dengan menambahkan larutan Na2CO3. Dalam hal ini, ion Ca2+ akan bergabung dengan ion karbonat (CO32-) membentuk CaCO3, suatu garam yang sukar larut, sehingga mengendap.

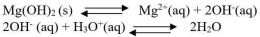
Bagaimana proses terbentuknya endapan AgCl ketika larutan NaCl ditetesi dengan larutan AgNO3? Apakah endapan AgCl terbentuk begitu ada ion Ag+yang memasuki larutan? Kita ingat kembali bahwa AgCl dapat larut dalam air, meskipun dalam jumlah yang sangat sedikit. Artinya ion Ag+dan ion Cl- dapat berada bersama-sama dalam larutan hingga larutan jenuh, yaitu sampai hasil kali [Ag+][Cl-] sampai dengan nilai Ksp AgCl. Apabila penambahan ion Ag+ dilanjutkan hingga hasil kali [Ag+][Cl-]> Ksp AgCl, maka kelebihan ion Ag2+ dan ion Cl- akan bergabung membentuk endapan AgCl. Jadi, pada penambahan larutan Ag+ ke dalam larutan Cl- dapat terjadi tiga hal sebagai berikut.
Jika [Ag+] [Cl-] < KspAgCl, larutan belum jenuh
[Ag+] [Cl-] = Ksp AgCl, larutan tepat jenuh
[Ag+] [Cl-] > Ksp AgCl, terbentuk pengendapan
Konsep Ksp dapat digunakan untuk memprediksikan terbentuknya endapan atau tidak pada suatu reaksi. Terbentuknya endapan atau tidak pada akhir proses reaksi tergantung pada molaritas ion-ion dipangkatkan dengan koefisiennya. Hasil kali molaritas awal dari ion-ion dalam larutan, dengan asumsi larutan terionisasi sempurna disebut kuotion reaksi. Kuotion reaksi disimbolkan “Qc”. Jika harga Ksp dan Qc dibandingkan, maka dapat diketahui apakah reaksi kimia membentuk endapan atau tidak.
Untuk mengetahui apa larutan dalam keadaan belum jenuh, tepat jenuh atau terbentuk endapan dapat dilihat dari harga Qc-nya, dengan ketentuan sebagai berikut:
- Qc < Ksp berarti larutan belum jenuh dan belum terbentuk endapan.
- Qc = Ksp berarti larutan tepat jenuh, tetapi belum terbentuk endapan.
- Qc > Ksp berarti larutan lewat jenuh dan terbentuk endapan.
Larutan belum jenuh: larutan yang jumlah zat terlarutnya masih kurang dari jumlah zat maksimum yang dapat larut sehingga belum diperoleh endapan. Larutan jenuh/tepat jenuh: larutan yang jumlah zat terlarutnya maksimum untuk dapat larut sehingga belum diperoleh endapan. Larutan lewat jenuh: larutan yang jumlah zatnya melebihi jumlah maksimum yang dapat larut sehingga terbentuk endapan.
Baca konten-konten menarik Kompasiana langsung dari smartphone kamu. Follow channel WhatsApp Kompasiana sekarang di sini: https://whatsapp.com/channel/0029VaYjYaL4Spk7WflFYJ2H