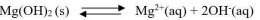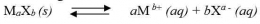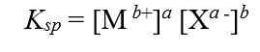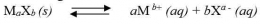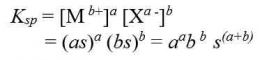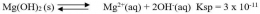Pengaruh pH Terhadap Kelarutan
Tingkat keasaman larutan (pH) dapat mempengaruhi kelarutan suatu zat. Suatu basa umumnya lebih larut dalam larutan yang bersifat asam, dan sebaliknya lebih sukar larut dalam larutan yang bersifat basa. Garam-garam yang berasal dari asam lemah akan lebih mudah larut dalam larutan yang bersifat asam kuat.
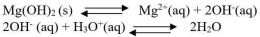
Perhatikan persamaan reaksi kesetimbangan Mg(OH)2 berikut :

Ion OH- dalam reaksi tersebut merupakan basa kuat karena ion tersebut adalah basa konjugasi dari asam lemah. Harga Ksp dari reaksi tersebut sangat kecil. Hal ini menunjukkan bahwa kelarutan Mg(OH)2 kecil dalam air.
1. Penambahan asam (pH diturunkan)

2. Penambahan basa (pH dinaikkan)

Kenaikan pH berarti penambahan konsentrasi OH- dalam larutan. Jika konsentrasi OH- bertambah reaksi akan bergeser ke arah reaktan, dengan kata lain kelarutan Mg(OH)2 menjadi lebih kecil.
- Kelarutan dari suatu senyawa ionik yang tersusun atas anion dari suatu asam lemah dapat ditingkatkan dengan penambahan asam atau penurunan pH dari larutan.
- Kelarutan dari suatu senyawa ionik yang tersusun atas anion dari suatu asam lemah dapat diturunkan dengan penambahan basa atau menaikkan pH dari larutan.
Senyawa ionik yang tersusun atas anion dari suatu asam kuat memiliki kelarutan dalam asam yang sama dengan kelarutannya dalam air. Hal ini terjadi karena anion dari asam kuat tersebut merupakan basa sangat lemah sehingga penambahan asam tidak akan berpengaruh pada kesetimbangan reaksi akibatnya kelarutan garam tersebut juga tidak berubah.