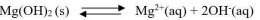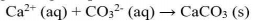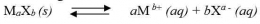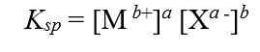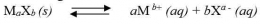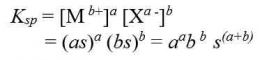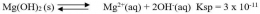Hubungan Antara Kelarutan (s) dan Tetapan Hasil Kelarutan (Ksp)
Secara umum,untuk kesetimbangan kelarutan berikut:

Hubungan tetapan hasil kali kelarutan (Ksp ) dengan kelarutan (s) dapat dirumuskan sebgai berikut:

Pengaruh Ion Senama Terhadap Kelarutan
Agar kalian dapat memahami pengaruh ion senama dalam kelarutan suatu zat maka perhatikan ilustrasi berikut, Apabila kalian mempunyai sebuah keranjang dan 8 bola. Kemudian, kalian akan mengisi keranjang tersebut dengan bola merah hingga keranjang tersebut penuh berisi bola, dan ternyata untuk memenuhi keranjang tersebut diperlukan semua bola merah yang kalian miliki (8 bola merah). Bagaimana jika keadaan awal keranjang tersebut tidak kosong melainkan sudah terdapat 4 buah bola merah di dalamnya? Tentu saja kapasitas dari keranjang telah kalian ketahui maka, kalian tidak dapat menambahkan 8 bola merah yang kalian miliki tetapi kalian hanya dapat memasukan 4 bola merah lagi ke dalam keranjang tersebut.
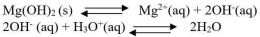
Jika ke dalam larutan jenuh AgCl ditambahkan beberapa tetes larutan NaCl maka akan segera terjadi pengendapan AgCl. Demikian pula bila ke dalam larutan AgCl tersebut ditambahkan beberapa tetes larutan AgNO3. Hal tersebut dapat dijelaskan dengan mempelajari reaksi kesetimbangan kelarutan AgCl.

Sesuai dengan Asas Le Chatelier, bila ke dalam sistem kesetimbangan tersebut ditambahkan ion Cl- maka kesetimbangan akan bergeser kekiri, sehingga mengakibatkan jumlah AgCl yang mengendap bertambah. Demikian pula bila ke dalam sistem kesetimbangan tersebut ditambahkan ion Ag+, maka sistem kesetimbangan tersebut akan bergeser ke kiri dan berakibat bertambahnya jumlah AgCl yang mengendap. Kesimpulannya bila ke dalam sistem kesetimbangan kelarutan ditambahkan ion senama akan mengakibatkan kelarutan senyawa tersebut berkurang.