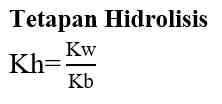
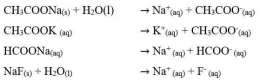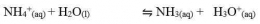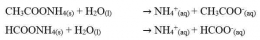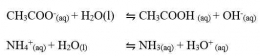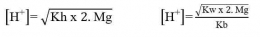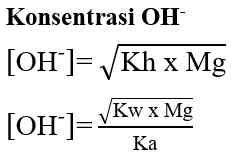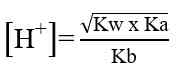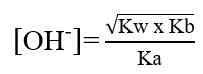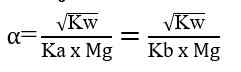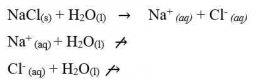Garam yang terhidrolisis di dalam air akan bersifat asam atau bersifat basa. Garam yang berasal dari reaksi asam kuat dan basa lemah akan menghasilkan ion H+ dan bersifat asam, sedangkan garam yang berasal dari reaksi basa kuat dan asam lemah akan menghasilkan ion OH- dan bersifat basa. Untuk mengetahui apakah suatu garam bersifat asam, basa atau netral dapat dilakukan analisis menggunakan kertas lakmus. Jika garam tersebut bersifat asam (memerahkan kertas lakmus) atau bersifat basa (membirukan kertas lakmus). Garam yang bersifat netral (tidak mengubah warna kertas lakmus). Secara umum garam dibedakan menjadi 3 yaitu:
1. Garam yang tidak terhidrolisis
Garam yang berasal dari asam kuat dan basa kuat tidak mengalami hidrolisis dan bersifat netral.
2. Garam yang terhidrolisis sebagian
Garam yang terhidrolisis sebagian ini biasanya terbentuk dari reaksi antara asam kuat dan basa lemah atau basa kuat dan asam lemah. Garam-garam ini biasanya bersifat asam atau basa.
3. Garam yang terhidrolisis sempurna
Garam yang terhidrolisis sempurna ini biasanya terbentuk dari reaksi antara asam lemah dan basa lemah. Garam-garam ini biasanya bersifat asam atau basa.
Reaksi Hidrolisis
1. Garam yang Berasal dari Asam Kuat dan Basa Kuat
Garam yang berasal dari dari asam kuat dan basa kuat tidak terhidrolisis. Hal ini dikarenakan ion-ion yang berasal dari asam kuat dan basa kuat tersebut tidak memiliki kecenderungan untuk membentuk asam atau basa asalnya. Sehingga garam yang berasal dari asam kuat dan basa kuat ini terionisasi sempurna dalam air. Sebagai contoh jika melarutkan NaCl murni dalam air, maka NaCl akan terionisasi sempuran menjadi Na+ dan Cl-. Persamaan reaksinya adalah: