"Asam adalah zat yang mendonorkan proton (H+) dan basa adalah zat yang menerima proton".
Pasangan asam-basa konjugasi
Reaksi antara asam dan basa Bronsted_Lowry disebut pertukaran proton. Jika asam disimbolkan sebagai HA dan basa disimbolkan sebagai B, maka reaksi umum asam-basa ini adalah

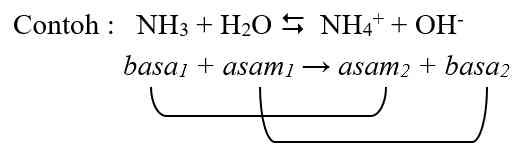
Skema reaksi dapat dilihat pada persamaan berikut

Reaksi ke kanan, NH3 menerima proton dari H2O. Jadi, NH3 adalah basa dan H2O adalah asam. Pada reaksi kebalikannya, NH4+ donor proton terhadap OH--. Oleh sebab itu, ion NH4+ adalah asam dan ion OH-- adalah basa. Spesi NH3 dan NH4+ berbeda dalam hal jumlah protonnya. NH3 menjadi ion NH4+ melalui pengikatan proton, sedangkan ion NH4+ menjadi NH3 melalui pelepasan proton. Spesi NH4+ dan NH3 seperti ini dinamakan pasangan konjugat asam basa.
Pasangan konjugat asam basa terdiri atas dua spesi yang terlibat dalam reaksi asam basa, satu asam dan satu basa yang dibedakan oleh penerimaan dan pelepasan proton. Asam pada pasangan itu dinamakan asam konjugat dari basa, sedangkan basa adalah basa konjugat dari asam. Jadi, NH4+ adalah asam konjugat dari NH3 dan NH3 adalah basa konjugat dari NH4+.
Teori Asam Basa Lewis
Teori asam basa terus berkembang dari waktu ke waktu. Pada tahun 1923, seorang ahli kimia Amerika Serikat, Gilbert N. Lewis, mengemukakan teorinya tentang asam basa berdasarkan serah terima pasangan elektron. Lewis berpendapat asam adalah partikel (ion atau molekul) yang dapat menerima (akseptor) pasangan elektron. Sedangkan basa didefinisikan sebagai partikel (ion atau molekul) yang memberi (donor) pasangan elektron.
Reaksi asam basa menurut Lewis berkaitan dengan pasangan elektron yang terjadi pada ikatan kovalen koordinasi. Perhatikan reaksi di bawah ini