Teori tumbukan menyatakan bahwa: "Reaksi kimia akan berlangsung apabila terjadi tumbukan-tumbukan antar partikelnya". Dengan kata lain, partikel-partikel reaktan atau pereaksi harus saling bertumbukan terlebih dahulu untuk menghasilkan hasil reaksi (produk). Tidak semua tumbukan dapat menghasilkan reaksi. Tumbukan antar partikel-partikel reaktan yang berhasil menghasilkan reaksi disebut tumbukan efektif, sedangkan tumbukan yang tidak menghasilkan reaksi disebut tumbukan efektif. Tumbukan efektif merupakan tumbukan yang mempunyai energi cukup untuk memutuskan ikatan-ikatan pada zat yang bereaksi. Ada 2 syarat yang menyebabkan terjadinya tumbukan efektif yaitu sebagai berikut.
- Energi Kinetik Partikel
Pada proses tumbukan partikel-partikel reaktan saling mendekat, namun akan terjadi gaya tolak-menolak antar elektron terluar dari masing-masing partikel. Gaya tolak menolak ini dapat diatasi jika energi kinetik dari partikel cukup sehingga dapat terjadi tumbukan yang efektif.
- Arah Partikel yang Bertumbukan
Pada proses tumbukan, partikel-partikel reaktan yang mempunyai orientasi atau arah yang tepat saat bertumbukan akan menghasilkan tumbukan yang efektif. Kedua syarat ini dapat dijelaskan pada contoh berikut, dimana reaksi terjadi antara molekul hidrogen (H2) dan molekul iodin (I2).
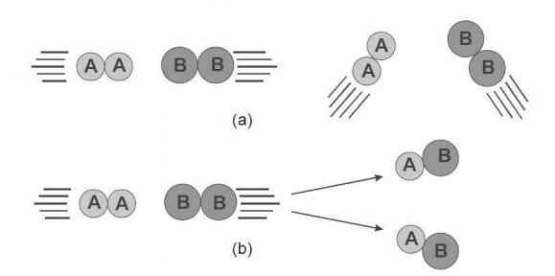
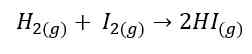
Untuk lebih jelasnya dapat dilihat pada gambar berikut.
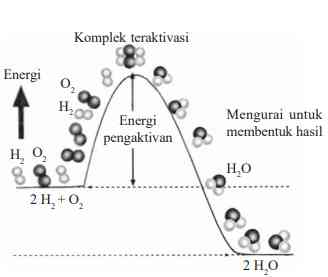
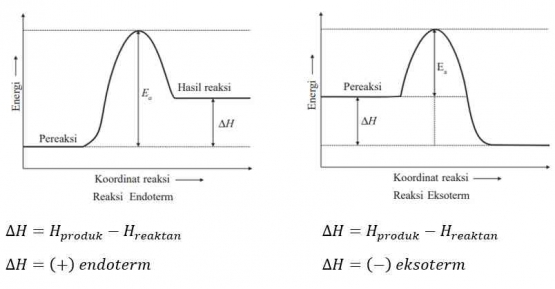
Faktor-faktor yang Mempengaruhi Laju Reaksi
Teori tumbukan dapat menjelaskan reaksi kimia dapat berlangsung atau tidak. Tumbukan antar partikel akan menghasilkan reaksi apabila memiliki energi yang cukup serta arah tumbukan yang efektif. Semakin banyak tumbukan efektif maka semakin cepat laju reaksinya. Faktor-faktor apa saja yang dapat mempengaruhi laju reaksi? Berdasarkan hasil percobaan, laju reaksi dipengaruhi oleh konsentrasi, luas permukaan, suhu, dan katalis (James E. Brady, 1990).
- Konsentrasi
Faktor utama yang mempengaruhi laju reaksi yang diberikan adalah konsentrasi reaktan. Reaksi dapat terjadi hanya ketika molekul reaktan bertabrakan. Konsentrasi adalah banyaknya partikel per satuan volum. Apabila konsentrasi pereaksi bertambah, maka jumlah partikel pereaksi akan semakin banyak. Bertambahnya jumlah partikel pereaksi akan memudahkan terjadinya tumbukan antar partikel pereaksi sehingga memungkinkan terjadinya reaksi yang semakin besar. Dengan demikian, semakin tinggi konsentrasi pereaksi maka menyebabkan laju reaksinya semakin cepat. Perhatikan gambar berikut ini.






















