Ikatan rangkap antara atom karbon disebut juga dua pasang elektron bersama. Salah satu dari pasangan elektron dipegang pada sebuah garis lurus antara dua inti karbon, namun pasangan lainnya dipegang dalam sebuah orbital molekul yang terdapat di atas dan di bawah bidang molekul tersebut. Orbital molekul adalah kebolehjadian tertinggi ditemukannya sepasang elektron.

Ikatan pi adalah pasangan elektron lain yang ditemukan di suatu tempat dalam bagian berarsir di atas atau di bawah bidang molekul. Elektron pi tidak sepenuhnya dikendalikan oleh inti karbon seperti pada elektron dalam ikatan sigma. Selain itu, karena elektron pi terletak di atas dan di bawah daerah kosong dari molekul, maka elektron-elektron ini relatif terbuka untuk diserang oleh lain.
5. Reaksi-Reaksi Pada alkena
a) Reaksi Adisi
Pada reaksi adisi, ikatan pi terputus dan elektron-elektron dari ikatan digunakan untuk menggabungkan dua atom karbon dengan yang lainnya.

Beberapa jenis reaksi adisi:
- Adisi hidrogen dan halogen (hidrogenasi dan halogenasi)
- Adisi halide hidrogen (hidrohaleganasi)
- Adisi H2SO4 dan H2O
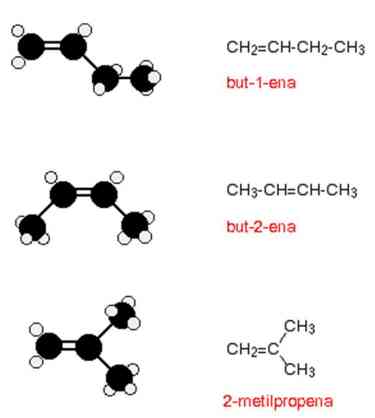
c. Alkuna
1. Pengertian dan Rumus alkuna
Alkuna merupakan deret senyawa hidrokarbon tidak jenuh yang mengandung satu ikatan rangkap tiga diantara dua atom C yang berurutan. Untuk membentuk ikatan rangkap tiga diperlukan 6 elektron, sehingga tersisa satu elektron pada tiap-tiap atom C untuk mengikat atom H. Jumlah atom H yang dapat diikat berkurang dua, sehingga rumus umumnya menjadi CnH2n+2 – 4H à CnH2n-2