Jawab: Bilangan kuantum azimuth untuk elektron terakhir dari unsur 20Ca adalah l = 0
3. Bilangan Kuantum Magnetik (m)
Bilangan kuantum magnetik (m) adalah suatu harga yang menyatakan orientasi orbital atau arah momentum sudut elektron dalam ruang. Orientasi orbital artinya tempat elektron bergerak di dalam atom, dimana masing-masing orbital menampung maksimal dua elektron atau sepasang. Nilai m bergantung pada bilangan kuantum azimuth yaitu semua bilangan bulat dari m = -l hingga +l termasuk nol (m = -l, ..., 0, ..., +l). Dengan demikian, setiap harga l yang diberikan pada setiap sub kulit, akan mendapat nilai m sebanyak (2l + 1).

4. Bilangan Kuantum Spin Elektron (s)
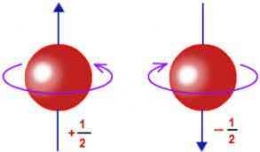
Bilangan kuantum spin elektron (s) adalah suatu harga yang menyatakan kedudukan dan arah putaran elektron pada suatu orbital. Seorang fisikawan mengansumsikan bahwa elektron berperilaku seperti magnet kecil. Elektron pada orbital tidak hanya bergerak di sekitar inti saja melainkan berputar pada sumbunya seperti rotasi bumi, sehingga sifat magnetiknya dapat dijelaskan. Teori elektromagnetik menjelaskan bahwa muatan yang berputar pada sumbunya akan menghasilkan medan magnet, sehingga menyebabkan gerakan elektron seperti medan magnet. Gerak elektron merupakan gerak yang searah dengan jarum jam dan berlawanan arah dengan jarum jam.
Di dalam suatu orbital terdapat dua elektron, sedangkan keduanya memiliki kutub pada orbital, maka dua elektron ini berputar mengelilingi sumbu dengan arah yang berlawanan, sehingga nilai elektron yang berpasangan dalam orbital harus berbeda. Perbedaan tersebut dinyatakan pada bilangan kuantum spin suatu elektron dalam orbital yang dapat bernilai +1/2 untuk searah jarum jam dan -1/2 untuk yang berlawanan arah jarum jam.

Baca konten-konten menarik Kompasiana langsung dari smartphone kamu. Follow channel WhatsApp Kompasiana sekarang di sini: https://whatsapp.com/channel/0029VaYjYaL4Spk7WflFYJ2H