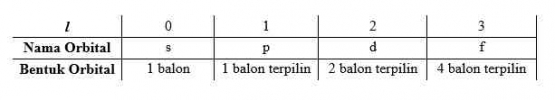
Bilangan kuantum azimuth atau momentum sudut (l) adalah suatu harga yang menyatakan tingkat energi elektron pada subkulit dan menyatakan bentuk orbital. Subkulit elektron mempunyai lambang s, p, d, f, dan seterusnya yang berasal dari nama-nama seri spektrum unsur yaitu sharp (s), principal (p), diffuse (d), dan fundamental (f).
Banyaknya subkulit tempat elektron berada bergantung pada nilai bilangan kuantum utama (n), bilangan kuantum momentum sudut l bernilai bulat dari 0 hingga n --1. Bila n = 1, hanya ada satu nilai l yang mungkin yaitu l = n -- 1 = 1 -- 1 = 0. Bila n = 2, ada dua nilai l, yaitu 0 dan 1. Bila n = 3, ada tiga nilai l, yaitu 0, 1, 2.
Sehingga:
Jika n = 1 maka l = 0
Jika n = 2 maka l = 0, 1
Jika n = 3 maka l = 0, 1, 2
Jika n = 4, maka l = 0, 1, 2, 3
Orbital-orbital dengan nilai n yang sama sering disebut dengan kulit. Sedangkan satu atau lebih orbital dengan nilai n dan l yang sama dikatakan sebagai subkulit. Misalnya, kulit dengan n = 3 terdiri atas 3 subkulit yaitu, l = 0, 1, 2 (nilai l yang diizinkan untuk n = 3). Subkulit ini disebut sebagai subkulit 3s, 3p, 3d dimana 3 melambangkan nilai n, dan s, p, dan d melambangkan nilai l. Semakin besar nilai n, maka semakin besar ukuran orbital dan semakin tinggi tingkat energinya.
Contoh soal: Tentukan bilangan kuantum azimuth untuk elektron terakhir dari unsur 20Ca!
20Ca = 1s2 2s2 2p6 3s2 3p6 4s2