Sebelumnya kita sudah membahas apa itu atom dan partikel-partikel yang menyusun atom, yaitu proton, neutron dan elektron. Nah pada bahasan ini kita akan lebih terfokus pada elektron. Apa dari kalian masih ingat apa itu elektron? Elektron merupakan partikel negatif dan memiliki jumlah yang sama dengan proton. Dari kata konfigurasi elektron, apakah kalian sudah tahu apa arti dari konfigurasi? Dalam KBBI konfigurasi memiliki arti kedudukan atom yang satu terhadap atom yang laun dalam molekul.
Secara khusus konfigurasi elektron memiliki arti suatu susunan atau tatanan penggambaran yang menunjukan penempatan elektron dalam suatu atom. Susunan elektron-elektron yang membangun suatu atom berdasarkan atas kulit ataupun orbital. Setiap elektron yang mengelilingi inti atom, terdapat kulit-kulit atom yang memiliki tingkatan energi yang berbeda-beda. Lintasan atau kulit yang terletak paling dekat dengan inti atom, memiliki tingkat energi paling rendah, dan semakin jauh lintasan dari intinya semakin tinggi juga tingkat energinya, dan jumlah elektron yang bisa ditampung pada kulit-kulit tersebut semakin banyak. Tiap-tiap kulit elektron hanya bisa mengisi atau menempati maksimum 2n^2 elektron, dengan n merupakan nomor kulit yang membangun suatu atom. Berikut merupakan tabel hubungan nomor kulit dengan nama kulit dan jumlah elektron yang bisa diisi.
Nomor Kulit
Nama Kulit
Jumlah Elektron Maksimum
Rumus 2n^2
Jumlah
1
K
2 (1)^2
2e
2
L
2 (2)^2
8e
3
M
2 (3)^2
18e
4
N
2 (4)^2
32e
5
O
2 (5)^2
50e
Dst..
dst
2 (n)^2
n e
Adapun beberapa aturan dalam menentukan konfigurasi elektron dari suatu atom.
1. Asas Aufbau
Kata Aufbau memiliki arti benda yang memiliki arti konstruksi, sehingga konsep prinsip Aufbau ini atas prinsip membangun. Berdasarkan asas Aufbau pengisian orbital dimulai dari subkulit dengan tingkat energi yang terendah sampai tingkat energi yang tertinggi. Sebelumnya sudah diketahui bahwa tingkat energi diketahui berdasarkan kulit. Kulit paling kecil memiliki arti tingkat energi paling kecil juga, jadi sesuai aturan ini jika di urutkan dari tingkat energi terendah ke yang tertinggi, maka urutan sesuai dengan urutan kulit yang dilambangkan dengan angka 1, 2, 3, 4, dst. Dalam hal ini berarti aturan aufbau ini berdasarkan pada bilangan utama (n) dan didasarkan bilangan azimuth atas subkulit s, p, d, f dengan muatan sesuai aturan di tabel tersebut. Urutan dari penulisan konfigurasi elektron berdasarkan aturan Aufbau adalah 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^10 4p^6 5s^2 4d^10 5p^6 6s^2 4f^14 dst. Dalam pengurutan ini juga berdasarkan atas perbandingan tingkat energi atau kulit dan bilangan kuantumnya. Contohnya:
Be dengan 4 elektron memiliki konfikurasi: 1s^2 2s^2
1. Larangan Pauli
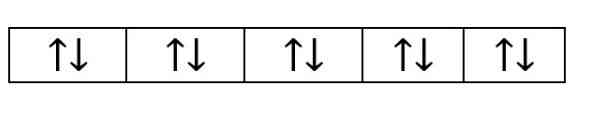
Asas larangan pauli merupakan suatu prinsip mekanika kuantum yang dirumuskan oleh seorang fisikiawan Wolfgang Pauli pada tahun 1925, sehingga asas ini dinamakan asas larangan Pauli. Berdasarkan atas larangan Pauli dikatakan bahwa tidak ada dua elektron dalam suatu atom yang memiliki empat bilangan kuantum yang sama. Pengisian elektron pada orbital dimaksimumkan berpasangan dan dinyatakan dalam bentuk orbital yang diisi naik dan juga turun seperti bilangan kuantum spin. Berarti dalam satu orbital maksimum terdapat dua elektron dengan spin yabg berbeda. Sehingga akan ada 2 elektron yang berpasangandan jumlah maksimum elektron setiap sub kulitnya adalah 2 kali jumlah orbitalnya dan dapat ditentukan dengan rumus 2 (n)^2. Subkulit s memiliki 1 orbital sehingga dapat digambar 1 kotak dan dan diisi satu elektron keatas dengan spin +1/2 dan satu lektron sebagai pasangannya yang ditulis terbalik dengan spin - 1/2.
3. Kaidah Hund
Kaidah Hund merupakan suatu kaidah yang berdasarkan atas keadaan dasar suatu atom atau molekul. Berdasarkan kaidah ini dinyatakan bahwa pengisian orbital atom dari sub kulit terkecil hingga sub kulit terbesar, dalam satu orbital sub kulit, elektronnya harus ditempatkan secara satu-satu terlebih dahulu sampai orbital terisi penuh baru diisi secara berpasangan dengan memperhatikan bilangan kuantum spin nya. Contoh dari konfigurasi elektron menurut kaidah hund yaitu sebagai berikut:
Misalkan menurut asas Aufbau konfigurasi Oksigen adalah 1s^2 2s^2 2p^4 sehingga jika berdasarkan kaidah Hund maka orbital pada kulit terakhir adalah:
- Penulisan konfigurasi juga berdasarkan atas hal-hal dibawah ini:
1. Penulisan Urutan Subkulit
Konfigurasi yang didasari kesesuaian urutan tingkat energi, maka urutannya sesuai dengan urutan tingkat energinya. Contohnya : Ni yang memiliki Eletron 28 konfigurasinya adalah: 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^8. Konfigurasi yang didasari kesesuaian urutan kenaikan bilangan kuantum, maka urutannya sesuai dengan urutan tingkat bilangan utama yang digunakan untuk penentuan valensi dari suatu atom. Dengan contoh yang sama yaitu Ni dengan jumlah elektron sebanyak 28 maka 1s^2 2s^2 2p^6 3s^2 3p^6 3d^8 4s^2
2. Penulisan dengan Konfigurasi Elektron Gas Mulia
Penulisan konfigurasi elektron dengan konfigurasi gas mulia biasanya digunakan untuk mempersingkat penulisan konfigurasi elektron. Sebelumnya hal yang harus diketahui adalah nomor atom ataupun elektron dari gas mulia dan juga konfigurasi dari gas mulia. Nomor atom gas mulia yaitu:
- He dengan nomor atom 2
- Ne dengan nomor atom 10
- Ar dengan nomor atom 18
- Kr dengan nomor atom 36
- Xe dengan nomor atom 54
- Rn dengan nomor atom 86
Setelah mengetahui nomor atom maka harus diketahui juga konfigurasi dari atom golongan gas mulia. Contohnya Ne memiliki konfigurasi 1s^2 2s^2 2p^6. Kemudian penentuan konfigurasi dari atom lain contohnya Mg dengan nomor atom atau elektron 12 maka dengan konfigurasi biasa: 1s^2 2s^2 2p^6 3s^2. Jika dibuat dengan konfigurasi menurut gas mulia maka akan terbentuk konfigurasi gabungan yang disebut dengan konfigurasi gas mulia yang ditulis dengan: [Ne] 3s^2.
3. Konfigirasi Elektron Ion
Penulisan konfigurasi elektron ion harus memperhatikan ion yang terbentuk, apakah kation atau anion. Hal tersebut sangat bekaitan karna terjadi penambahan dan pengurangan elektron.
Misalkan atom Na memiliki konfigurasi: 1s^2 2s^2 2p^6 3s^1 ketika atom Na berubah menjadi kation maka atom Na akan kehilangan 1 elektronnya sehingga konfigurasinya berubah menjadi 1s^2 2s^2 2p^6.
Kemudian atom Cl memiliki 17 elektron konfigurasi: 1s^2 2s^2 2p^6 3s^2 3p^5 ketika atom Cl berubah menjadi anion maka atom Cl akan mendapatkan penambahan 1 elektronnya sehingga konfigurasinya berubah menjadi 1s^2 2s^2 2p^6 3s^2 3p^6.
4. Konfigurasi untuk Golongan Transisi
Untuk golongan trasnisi terjadi pelencengan aturan dari aturan Aufbau yang telah disampaikan sebelumnya. Menurut aturan Aufbau konfigurasi elektron misalnya atom Cu dengan jumlah elektron 29 konfigurasi menurut tingkatannya yaitu 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^9, dan jika ditulis menurut kenaikan bilangan kuantumnya 1s^2 2s^2 2p^6 3s^2 3p^6 3d^9 4s^2.
Menurut aturan ini jika nilai elektron pada orbital d bernilai 4 akan menjadi setengah penuh yaitu dimaksimalkan menjadi 5 karena d memiliki nilai penuhnya 10 elektron. Jika nilai d pada konfigurasinya adalah 9 maka akan dipenuhkan menjadi 10. Seperti pada konteks Cu tersebut menurut aturan penuh maka konfigurasinya menjadi: 1s^2 2s^2 2p^6 3s^2 3p^6 3d^10 4s^2.
Baca konten-konten menarik Kompasiana langsung dari smartphone kamu. Follow channel WhatsApp Kompasiana sekarang di sini: https://whatsapp.com/channel/0029VaYjYaL4Spk7WflFYJ2H