Fasa atas(air)Dititrasi NaOH (VNaOH)=7 ml
Fasa Bawah(eter)Dititrasi NaOH(VNaOH)=0,5 ml
0.2 M
Fasa atas (air) Dititrasi NaOH (VNaOH) =5 ml
Fasa bawah (etee) Dititrasi NaoH (VNaOH)= 0.5 ml
Metode penentuan koefisien distribusi asam asetat dilakukan dengan penentuan konsentrasi asam asetat baik yang ada dalam fasa air maupun fasa organik. Pelarut organik yang digunakan dalam percobaan ini adalah Petrolium Eter.
Langkah pertama asam asetat dititrasi dengan NaOH 0,5 N menggunakan indikator pp sampai berubah warna dari bening menjadi merah muda. Titrasi ini bertujuan untuk mengetahui berapa besar massa asam asetat total yang akan terdistribusi pada pelarut organik dan air. Langkah berikutnya, asam asetat diekstraksi dengan mencampurkan pada pelarut organik seperti Petrolium. Ketika dimasukkan ke dalam corong pisah, kedua fasa tersebut tidak saling campur. Campuran ini kemudian dikocok beberapa menit, sehingga mengakibatkan terjadinya distribusi asam asetat ke dalam fasa organik dan fasa air. Fungsi pengocokan disini untuk membesar luas permukaan untuk membantu proses distribusi asam asetat pada kedua fasa.
Setelah tercapai kesetimbangan pada corong pisah, campuran kemudian didiamkan dan terbentuk dua lapisan. Pada pelarut Petrolium eter, asam asetat yang larut dalam air akan berada di lapisan bawah, sedangkan larutan asam asetat yang larut dalam pelarut Petrolium eter berada pada lapisan atas. Hal ini terjadi karena perbedaan berat jenis pelarut organik dengan berat jenis air. Larutan asam asetat yang larut dalam air (lapisan airnya) diambil, kemudian dititrasi dengan NaOH 0.5 N dan indikator pp. Pada titik akhir titrasi terjadi perubahan wama dari bening menjadi merah muda. Reaksi yang terjadi adalah sebagai berikut:
CH3COOH-NaOH → CH3COONa + H₂O
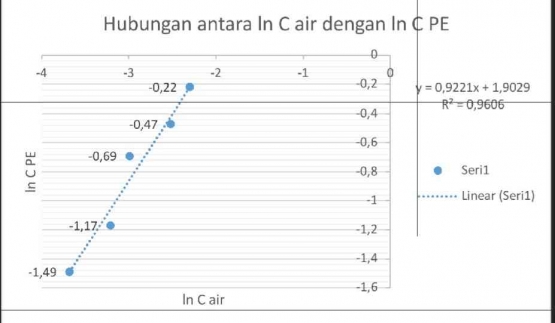
Petrolium eter tidak dapat bercampur karena berbeda kepolarannya. dan juga berat jenis air lebih besar dibandingkan petrolium eter, itu sebabnya air berada dibawah dan petrolium eter berada diatas pada saat didalam corong pisah. Pada percoaan kali ini hasil konsentasi dari penentuan konsentrasi asam asetat mula mula untuk CH.COOH 1,0 М yaitu 0,9M, untuk CH3COOH 0.8 yaitu 0,775M. untuk CH3COOH 0,6 M yaitu 0.55M, untuk CH,COOH 0.4 M yaitu 0,35M, untuk CHCOOH 0,2 M yaitu 0,25 M. Dan pada penentuan konsentrasi asam asetat seletat kesetimbangan CHCOOH 1,0 M yaitu 0,1M, untuk CH.COOH 0,8 M yaitu 0,08M, untuk CH:COOH 0,6 M yaitu 0,05M, untuk CH,COOH 0,4 M yaitu 0.04M. untuk CHCOOH 0,2 M yaitu 0.025M. Sedangkan konsentrasi petrolium eter CH COOH 1,0 M yaitu 0.8 M, untuk CH,COOH 0,8M yaitu 0,695 M, untuk CH,COOH 0,6 M yaitu 0,5M, untuk CH,COOH 0,4 M yaitu 0.31M, untuk CHCOOH 0,2 M yaitu 0.225 M. Nilai k yang diperoleh akan menunjukkan kemampuan solute terdistribusi dalam solven ke 2 (asam asetat dan air) terhadap solven 1 (toluen)