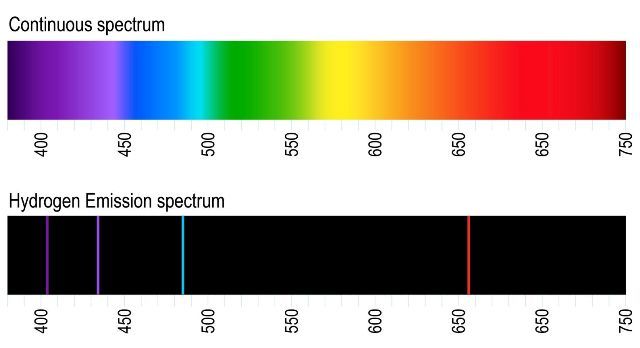
Meski teori atom Bohr bukan merupakan teori atom yang sempurna, teori ini tetap diterima secara umum karena keberhasilannya menjawab teka-teki emisi spektrum atom Hidrogen pada masa itu. Eksperimen menunjukkan bahwa ketika atom (gas) hidrogen dipanaskan maka akan memancarkan radiasi cahaya tampak. Namun, radiasi cahaya tampak ini hanya pada 4 jenis panjang gelombang diskrit. Sebaliknya, umum diketahui bahwa cahaya putih seharusnya merupakan pancaran radiasi yang kontinu pada seluruh rentang frekuensi. Lihat perbandingan pada gambar hydrogen emission spectrum.
Fenomena emisi atom hidrogen baru mulai sedikit dipahami secara teoritis pada tahun 1885, setelah matematikawan Swiss Johann Balmer menemukan perhitungan yang cocok untuk fenomena tersebut. Balmer menunjukkan bahwa setiap panjang gelombang dalam spektrum cahaya tampak dari atom hidrogen berkaitan dengan bilangan bulat.
Pada tahun 1888, perumusan Balmer digeneralisasi oleh Johannes Rydberg, sehingga lahir persamaan yang disebut rumus Rydberg. Hebatnya, rumus Rydberg bukan saja menjelaskan empat panjang gelombang cahaya tampak dari atom hidrogen, tetapi juga memprediksi panjang gelombang tambahan dalam spektrum emisi. Dua dekade kemudian prediksi ini terbukti secara eksperimental oleh Louis Paschen yang menemukan beberapa panjang gelombang inframerah pada tahun 1908, serta Theodore Lyman yang menemukan beberapa panjang gelombang ultraviolet pada tahun 1914.
Walau demikian, rumus Balmer maupun rumus umum dari Rydberg hanya menunjukkan secara perhitungan bahwa panjang gelombang berhubungan dengan faktor bilangan bulat. Atau, bisa dikatakan bahwa agar rumus perhitungan dapat sesuai dengan data eksperimen dari emisi spektrum atom hidrogen, maka diperlukan faktor bilangan bulat. Apa arti fisis dari bilangan bulat ini masih belum diketahui pada saat itu. Teka-teki ini baru bisa dipahami setelah teori kuanta energi dicetuskan oleh Planck, yang didukung Einstein, bahwa faktor bilangan bulat tersebut mendeskripsikan sifat dari atom terkuantisasi. Hal ini semakin diperjelas oleh teori atom Bohr yang sangat baik dalam mendeskripsikan struktur atom berelektron 1 yang identik dengan atom hidrogen. Dalam teori atom Bohr, atom hidrogen mengemisikan energi radiasi ketika elektron melompat dari kulit elektron luar ke kulit elektron dalam. Jadi, lintasan elektron atau jari-jari atom terkuantisasi.
Dalam bilangan bulat, pertambahan nilai atau bilangan adalah diskrit, atau bertambah dengan jumlah satuan angka yang pasti, misalnya dari 1 ke 2, 2 ke 3 dan seterusnya. Oleh karena itu disebut diskrit atau dalam ranah kuantum disebut terkuantisasi. Sedangkan yang dimaksudkan dengan kontinu adalah ketika bergerak dari bilangan 1 ke bilangan 2 maka harus melewati bilangan desimal, misalnya 1,1 lalu 1,2 dan seterusnya. Jadi, perubahannya terjadi secara halus atau berkesinambungan. Oleh karena itu disebut kontinu.
Perumusan Bohr identik dengan apa yang dirumuskan Balmer atau rumus umum yang dikemukakan Rydberg. Perbedaannya adalah dalam perhitungan Bohr, energi berhubungan dengan panjang gelombang yang dikalikan dengan konstanta Planck, sedangkan rumus Rydberg belum mengenal konstanta Planck. Lebih jauh lagi, dalam men-generalisasi rumus Balmer, Rydberg mengusulkan sebuah konstanta yang disebut konstanta Rydberg. Konstanta Rydberg ini kemudian berhasil dirumuskan oleh Bohr sebagai hasil pembagian dari faktor konstanta Coulomb dan muatan elektron terhadap jari-jari Bohr, konstanta Planck dan kecepatan gelombang elektromagnetik (cahaya). Ketika Rydberg mengusulkan konstanta-nya dalam perhitungan emisi atom hidrogen, masih belum jelas apakah konstanta itu memiliki makna fisis atau merupakan sebuah konstanta yang fundamental? Niels Bohr-lah yang berhasil menguraikan konstanta Rydberg ke konstanta-konstanta yang lebih fundamental. Jadi, model atom Bohr berhasil menghubungkan dan memprediksi spektrum atom hidrogen berdasarkan konstanta-konstanta fundamental.
Teori Bohr merupakan sebuah langkah maju yang brilian dalam membuka pintu kajian atom modern atau teori atom mekanika kuantum. Terdapat dua fitur penting dari atom Bohr tetap bertahan sampai sekarang; pertama tentang keberadaan keadaan (orbit) stasioner dan yang kedua tentang hubungan frekuensi radiasi terhadap perbedaan energi antara keadaan awal dan keadaan akhir dalam suatu transisi elektron. Sebelum Bohr, fisikawan berpendapat bahwa frekuensi radiasi akan sama dengan frekuensi rotasi elektron dalam orbit. Atas pencapaiannya ini, ditambah dengan kontribusinya dalam perkembangan teori kuantum, Bohr dianugerahi hadiah nobel fisika pada tahun 1922.
Baca juga:
- Perkembangan Teori Kuantum Pertama: Teori Atom Bohr part 1
- Perkembangan Teori Kuantum Pertama: Efek Fotolistrik
- Perkembangan Teori Kuantum Pertama: Radiasi Benda Hitam
- Mengenal fisika kuantum
- Dimensi Ekstra dalam ilmu fisika
- Apa itu teori string ?
- Mengenal gravitasi
Follow Instagram @kompasianacom juga Tiktok @kompasiana biar nggak ketinggalan event seru komunitas dan tips dapat cuan dari Kompasiana
Baca juga cerita inspiratif langsung dari smartphone kamu dengan bergabung di WhatsApp Channel Kompasiana di SINI