Teori Lewis
Struktur Lewis adalah penggambaran distribusi elektron dalam suatu struktur molekul dengan menggunakan tanda elektron. Tanda elektron yang digunakan, biasanya berupa tanda titik (.) dan tanda silang (x), sehingga teori Lewis ini sering juga disebut sebagai teori dot-cross Lewis.
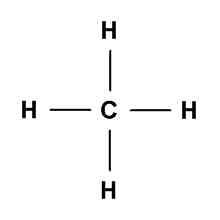
Ketika atom karbon (C) berikatan dengan atom hidrogen (H) makan setiap atom C mampu mengikat 4 atom H membentuk CH4. Setiap elektron dari atom H akan berikatan dengan satu elektron dari atom C, sehingga antara C dengan H terdapat satu pasang elektron ikatan (PEI). Dalam atom C terdapat empat elektron yang tidak berpasangan sehingga untuk memenuhi kaidah oktet diperlukan empat atom H.

Setelah berikatan akan didapatkan 4 pasang elektron ikatan bersama antara atom C dan H, sehingga didapatkan struktur Lewis antara C dan H menjadi seperti berikut:

Kemudian, satu pasang elektron ikatan (PEI) dapat diganti dengan sebuah garis atau lengan ikatan. Dalam CH4 terdapat empat pasang elektron ikatan, sehingga terdapat 4 garis atau lengan ikatan, bisa dilihat pada gambar berikut:
 www.ruangguru.com
www.ruangguru.com

Muatan Formal
Muatan formal (atau disebut juga muatan resmi) adalah suatu perhitungan yang dapat digunakan pada struktur Lewis untuk menentukan muatan dari atom–atom yang membentuk suatu ikatan ionik maupun ikatan kovalen. Muatan formal merupakan jumlah elektron valensi dalam atom bebasnya dikurangi dengan jumlah elektron yang dimiliki oleh atom tersebut dalam sruktur Lewisnya. Untuk menentukan jumlah elektron atom dalam struktur Lewisnya dapat digunakan aturan sebagai berikut:
- Semua elektron non-ikatan dalam atom dinyatakan sebagai milik atom tersebut
- Membagi ikatan antara atom tersebut dengan atom lain dan menyatakan bahwa separuh elektron ikatannya sebagai milik atom tersebut
Muatan formal dapat digunakan dalam menentukan struktur yang stabil dari suatu ikatan. Bila ada beberapa kemungkinan struktur Lewis yang dapat dibuat, maka struktur dengan muatan formal terkecil dan paling stabil yang dipilih.
Kadang-kadang terdapat lebih dari satu struktur Lewis yang mungkin untuk spesi tertentu. Pada kasus seperti ini, muatan formal dapat membantu untuk memilih struktur Lewis yang lebih disukai. Petunjuk penggunaannya adalah sebagai berikut:
- Pada Molekul Netral, strukutur Lewis tanpa muatan formal lebih disukai daripada struktur yang memiliki muatan formal
- Struktur Lewis dengan muatan formal yang besar (2+, 3+, dan/atau 2-, 3-, dst) kurang disukai daripada struktur dengan muatan formal yang kecil
- Untuk struktur Lewis dengan distribusi muatan ormal yang serupa, struktur yang muatan negatifnya berada pada atom yang lebih elektronegatif lebih disukai.
Teori VSEPR
Teori VSEPR mulai diperkenalkan oleh Nevil’s dan Herbert P pada tahun 1940 dan dikembangkan oleh Ronald G dan R. Nyholm. Teori ini memungkinkan untuk digunakan meramal pengaturan atom- atom yang beriktan kovalen dalam suatu molekul poliatomik.











