Larutan Asam dan Basa
Nama: Nikodemus Sangap Situmorang
NIM: 2013031022
Indikator asam basa adalah suatu zat yang memberikan warna yang berbeda pada larutan asam dan basa. Jadi dengan menggunakan indikator asam basa bisa diketahui apakah suatu zat bersifat asam atau basa. Ada beberapa jenis indikator asam basa yaitu: indikator alami, kertas lakmus dan indikator universal. Indikator universal ini terbagi menjadi dua jenis ada yang dalam bentuk kertas indikator dan ada yang dalam bentuk larutan indikator.
- indikator alami. indikator alami adalah indikator yang berasal dari bahan alam yang menunjukkan warna yang berbeda dalam larutan asam basa dan netral. indikator alami ini bisa berasal dari bunga-bungaan sayur-sayuran ataupun buah-buahan. ingat indikator alami yang digunakan bukan dalam bentuk asli ya tapi sudah diekstraksi atau dalam bentuk larutannya. Berikut ini adalah tabel indicator alami.
- Kertas lakmus, kertas lakmus terdiri dari 3 warna ada kertas lakmus merah dan biru, bagaimana cara menentukan sifat larutan asam atau basa dari suatu larutan dengan menggunakan kertas lakmus? Bisa dilihat pada tabel yang sudah saya sediakan:
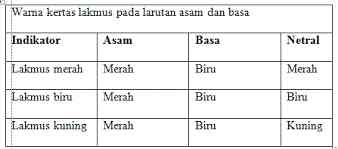
- Indikator universal. indikator universal terdiri dari dua bentuk ada yang berbentuk kertas-dan ada yang berbentuk larutan.
1. Kertas indikator universal adalah sebuah kertas dengan beberapa warna yang digunakan untuk mengukur PH sebuah larutan jadi jika indikator alami dan kertas lakmus hanya bisa membedakan mana yang bersifat asam dan mana yang bersifat basa. Indikator universal sudah bisa memperkirakan ph-nya di mana jika ph-nya sama dengan 7 berarti larutan bersifat netral, jika ph-nya kurang dari 7 maka larutan bersifat asam dan jika ph-nya lebih dari 7 maka larutannya bersifat basa.

2. Larutan indikator universal ada beberapa larutan indikator universal masing-masing larutan indikator tersebut memiliki trayek PH beserta perubahan warna dari PH rendah ke PH tinggi. salah satu contohnya adalah larutan indikator bromtimol biru atau (BTB). Indikator btb memiliki trayek pH dari 6,0 sampai 7,6 dan perubahan warna yang terjadi dari kuning ke biru. Jadi misal suatu larutan diuji menggunakan indikator BTB jika hasil ujinya menunjukkan warna kuning berarti perkiraan ph-nya adalah kurang dari 6,0 jika hasil ujinya berwarna biru maka ph-nya besar dari 7,6 sedangkan jika hasilnya berwarna hijau berarti bukan kuning dan bukan biru maka perkiraan ph-nya adalah di antara 6,0 sampai 7,6 biasanya untuk menguji suatu larutan digunakan beberapa jenis larutan indicator.
Kekuatan asam dipengaruhi oleh banyaknya ion-ion H+ yang dihasilkan oleh senyawa dalam larutannya, jadi berdasarkan banyaknya ion-ion H+ yang dihasilkan tersebut maka larutan asam dikelompokkan menjadi dua yaitu asam kuat dan asam lemah. Perbedaan dari kedua asam ini yaitu, larutan asam kuat adalah larutan yang dapat menghantarkan arus listrik dengan kuat atau disebut juga dengan larutan elektrolit kuat sedangkan asam lemah juga dapat menghantarkan arus listrik tetapi tidak kuat atau disebut juga larutan elektrolit lemah. Kenapa asam kuat menghantarkan arus listrik dengan kuat?. Ternyata dalam air atau dalam larutannya hampir seluruh asam kuat terurai menjadi ion-ionnya sehingga dianggap bahwa asam kuat terionisasi sempurna contoh: asam klorida (HCL) ketika HCL dilarutkan ke dalam air maka semuanya akan terionisasi menjadi ion H+ dan ion Cl-. Asam lemah hanya dapat menghantarkan arus listrik dengan lemah karena jumlah ionnya sedikit. Kenapa sedikit? karena asam lemah apabila dilarutkan ke dalam air hanya akan terionisasi sebagian contoh: asam asetat (CH3COOH) CH3COOH ini apabila dilarutkan ke dalam air maka akan terionisasi sebagian menghasilkan ion H+ dan ion CH3COO-. Sebagiannya lagi masih terdapat dalam bentuk molekul CH3COOH makanya reaksinya setimbang atau bolak-balik. Untuk asam kuat karena terionisasi sempurna berarti memiliki derajat ionisasi atau Alfa (α)=1 sedangkan asam lemah karena terionisasi sebagian maka derajat ionisasi atau alfanya besar dari 0 dan kecil dari 1. Kemudian untuk asam lemah karena reaksi ionisasinya merupakan reaksi kesetimbangan atau reaksi bolak-balik maka asam lemah ini memiliki tetapan kesetimbangan, yang disebut dengan tetapan kesetimbangan asam dan dilambangkan dengan Ka. Untuk membedakan yang mana asam kuat dan asam lemah caranya adalah hafalkan saja asam kuat berarti selain asam kuat maka itu adalah asam lemah. Yang termasuk asam kuat adalah asam klorida (HCL), asam bromida (HBr), asam iodida atau (HI), asam nitrat (HNO3) asam sulfat (H2SO4), asam klorat atau (HClO3) dan asam perklorat atau (HClO4) berarti yang tidak termasuk asam kuat adalah asam lemah. Contohnya adalah asam florida (HF), asam sulfida (H2S), asam fosfat (H3PO4), asam nitrit (HNO2) dan masih banyak contoh yang lainnya. Kekuatan asam bisa juga dilihat dari harga Ka atau tetapan kesetimbangan asamnya, yaitu makin besar harga Ka maka sifat asam relatif makin kuat.
Selanjutnya yaitu cara menentukan derajat keasaman atau PH suatu larutan asam. Untuk menentukan PH suatu larutan asam bisa menggunakan rumus PH = -log[H+], rumus ini berlaku untuk asam kuat maupun asam lemah. Kemudian untuk mencari PH berarti harus diketahui dulu berapa [H+] nya. Cara mencari konsentrasi ion H+ untuk asam kuat [H+] bisa dicari dengan menggunakan rumus [H+] = a × Ma. Di mana:
a = valensi asam (jumlah ion h+)
Ma = Molaritas (konsentrasi larutan asam)
kemudian untuk asam lemah [H+] bisa dicari dengan menggunakan dua rumus. Jika nilai Ka nya diketahui maka rumus yang digunakan adalah [H+] = Ka.Ma tetapi jika yang diketahui Alfa atau derajat ionisasinya maka rumus yang kita gunakan adalah [H+] = α.Ma jadi rumus ini digunakan jika Ka nya diketahui dan jika alfanya yang diketahui.
Ka = tetapan ionisasi (kesetimbangan asam)
α = derajat ionisasi
Kekuatan basa dipengaruhi oleh banyaknya ion-ion OH- yang dihasilkan oleh senyawa dalam larutannya berdasarkan banyaknya ion-ion OH- yang dihasilkan tersebut maka basa dikelompokkan menjadi dua yaitu basa kuat dan basa lemah. Perbedaan antara larutan basa kuat dengan larutan basa lemah adalah, basa kuat adalah larutan yang dapat menghantarkan listrik dengan kuat atau disebut juga dengan larutan elektrolit kuat kenapa dapat menghantarkan listrik dengan kuat karena ternyata di dalam air atau di dalam larutannya hampir seluruh basa kuat terurai menjadi ion-ionnya, sehingga dianggap bahwa basa kuat terionisasi sempurna. Contoh: NaOH apabila dilarutkan ke dalam air semuanya akan terionisasi menjadi ion and Na+ dan ion OH-. Jadi karena jumlah ion yang dihasilkan banyak sehingga termasuk larutan elektrolit kuat dan karena jumlah ion OH- yang banyak sehingga disebut dengan basa kuat. suatu senyawa yang terionisasi sempurna akan memiliki derajat ionisasi (α) = 1. Basa lemah itu termasuk larutan elektrolit yang dapat menghantarkan listrik dengan lemah atau disebut juga dengan larutan elektrolit lemah. Karena apabila basa lemah dilarutkan ke dalam air maka hanya akan terionisasi sebagian sehingga ion yang dihasilkan lebih sedikit dibandingkan dengan basa kuat. contoh Al(OH)3 apabila dilarutkan ke dalam air maka akan menghasilkan ion Al3+ dan 3 ion OH-. Sebagiannya lagi masih dalam bentuk molekul Al(OH)3 sehingga reaksinya bolak-balik atau setimbang. Karena hanya terionisasi sebagian berarti basa lemah memiliki derajat ionisasi (α), besar dari 0 dan kecil dari satu. Kemudian karena reaksinya Setimbang atau bolak-balik berarti basa lemah memiliki tetapan kesetimbangan, yang disebut juga dengan tetapan kesetimbangan atau tetapan ionisasi basa yang dilambangkan dengan Kb. Cara membedakan senyawa-senyawa yang termasuk basa kuat dan senyawa-senyawa yang termasuk basa lemah caranya adalah sama seperti asam, hafalkan yang basa kuat. Senyawa basa kuat adalah senyawa yang terbentuk dari unsur-unsur golongan 1A dan golongan 2A. dari golongan 1A yaitu LiOH, NaOH, KOH, RbOH dan CsOH, kemudian dari golongan 2A yaitu Ca(OH)2, Sr(OH)2 dan Ba(OH)2. Jadi senyawa-senyawa basa lain yang tidak termasuk basa kuat maka termasuk basa lemah. beberapa contohnya adalah Be(OH)2, Fe(OH)2 dan NH4OH. Kekuatan basa lemah dengan basa lemah lainnya dapat juga dilihat dari harga tetapan kesetimbangan (Kb), makin besar harga Kb maka sifat basa akan relatif semakin kuat.









