Pada tahun 1927, ilmuwan Austria Erwin Schrdinger menerbitkan teori atom yang disebut teori atom mekanika kuantum atau mekanika gelombang. Teori ini telah lama diterima oleh para ahli. Teori mekanika kuantum mirip dengan teori atom Niels Bohr dalam hal tingkat energi dan kulit atom, tetapi berbeda dalam bentuk orbital. Dalam teori atom mekanika kuantum, posisi elektron dikatakan tidak pasti dan hal yang dapat ditentukan adalah wilayah di mana elektron paling mungkin ditemukan yang dapat ditentukan dengan keberadaan elektron dalam atom. Daerah dengan probabilitas tertinggi menemukan elektron disebut "orbital" (lintasan).
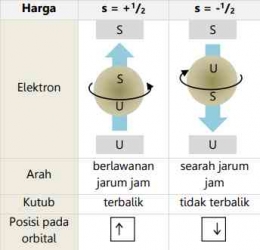
Menurut teori atom modern, elektron ada dalam orbital dan setiap orbital memiliki tingkat atau bentuk energi tertentu. Satu atau lebih orbital dengan tingkat energi yang sama membentuk subkulit. Bilangan kuantum digunakan untuk menentukan tingkat energi elektron dan digunakan untuk menggambarkan posisi elektron dalam orbitnya. Schrdinger menggunakan tiga bilangan kuantum: bilangan kuantum utama (n), bilangan kuantum azimut (l), dan bilangan kuantum magnetik (m). Ketiga bilangan kuantum ini adalah bilangan bulat sederhana yang menggambarkan kemungkinan menemukan elektron dalam atom dan untuk menggambarkan arah putaran elektron terhadap sumbunya, para ahli menggunakan bilangan kuantum spin (s).
Itu tadi terkait kronologi terkait timbulnya bilangan kuantum. Mari kita simak lebih lanjut terkait pokok-pokok dari bilangan kuantum tersebut.
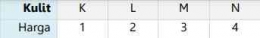
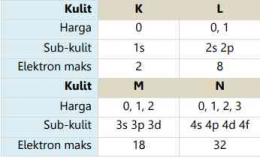
Bilangan kuantum utama merupakan suatu harga yang menyatakan tingkatan energi atau kulit dalam atom atau secara sungkatnya bilangan kuantum utama ini menyatakan kulit tempat ditemukannta elektron. Bilangan kuantum utama ini dilambangkan dengan huruf "n" yang dinyatakan dalam bilangan bulat positif, yaitu: n= 1,2,3, .... Jenis kulit konfigurasi elektronnya dilambangkan dengan huruf seperti K, L, M, dan N. Kulit yang paling dekat dengan inti adalah kulit K dengan bilangan kuantum utama kulit = 1. Kulit berikutnya adalah L dengan bilangan kuantum utama = 2, dan begitu juga seterusnya untuk kulit-kulit berikutnya.
Berikut ini tabel terkait barga bilangan kuantum uama:
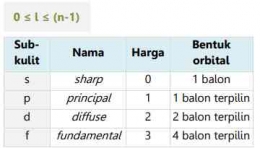
Bilangan Kuantum Azimut (l)
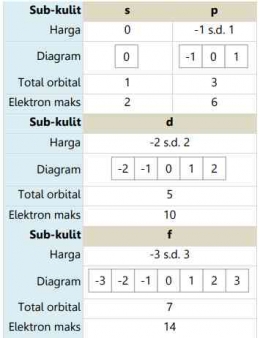
Mekanika gelombang menunjukan bahwa setiap kulit tersusun atas beberapa subkulit. Bilangan kuantum azimuth merupakan suatu harga yang menyatakan sub kulit (s, p, d, f) atom dan bentuk geometri orbitalnya. Bilangan kuantum azimuth ini dilambangkan dengan huruf "l". Bilangan kuantum azimut memiliki nilai dari 0 hingga (n-1) untuk setiap n dan menunjukkan posisi elektron dalam subkulit. Misalnya, setiap elektron dengan nilai l = 0 memiliki bentuk orbital seperti bola. Ini berarti bahwa probabilitas (kebolehjadian) untuk menemukan elektron ke segala arah dari inti adalah sama.
Elektron dengan harga l=0, artinya elektron tersebut berada pada sub kulit s (sharp)
Elektron dengan harga l=1, artinya elektron tersebut berada pada sub kulit p (principle)