1. Uji Eksperimental In Vitro
Ekstrak atau senyawa obat diberikan pada kultur sel atau mikroba, kemudian diamati efek yang ditimbulkan.
2. Uji Eksperimental In Vivo
Ekstrak atau senyawa obat diberikan pada hewan coba yang telah disebutkan tadi, kemudian diamati efek yang ditimbulkan.

Uji toksisitas bertujuan untuk mempelajari efek toksik (beracun) dari suatu senyawa. Efek toksik ini bisa berupa efek karsinogenik (pemicu kanker), teratogenik (berbahaya pada janin), mutagenik (perubahan rantai genetik), dan lainnya.
Berdasarkan Peraturan Kepala BPOM nomor 7 tahun 2014 tentang Pedoman Uji Toksisitas Nonklinik secara In Vivo, Uji Toksisitas ini mencakup 10 jenis. Namun yang paling umum dilakukan adalah Uji Toksisitas Akut dan Uji Toksisitas Subkronik.
Uji Toksisitas Akut (LD50), bertujuan untuk mendeteksi efek toksik suatu zat yang muncul dalam waktu singkat setelah pemberian dosis tunggal atau dosis berulang dalam waktu 24 jam. LD50 atau Lethal Dose 50 berarti dosis maksimal yamg dapat menyebabkan kematian pada 50% hewan uji.
Sedangkan Uji Toksisitas Subkronik, bertujuan untuk mendeteksi efek toksik yang muncul setelah pemberian suatu dosis setiap hari selama 28 atau 90 hari.
Jika calon obat baru tidak lulus Uji Pre-Klinik, maka calon obat baru tersebut tidak bisa dilanjutkan ke Uji Klinik.
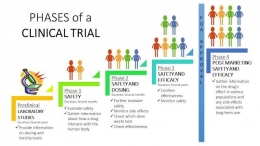
Uji Klinik
Setelah lulus dalam Uji Pre-Klinik, barulah calon obat baru diperbolehkan untuk dicobakan pada manusia. Dan ada empat fase Uji Klinik yang harus dilalui:
Fase I
Pada fase ini, calon obat diuji pada sekelompok sukarelawan sehat (misal 25 -- 50 orang).
Fase II
Pada fase ini, calon obat diuji pada sekelompok pasien (misal 100-200 orang), kemudian diamati efek yang ditimbulkan. Uji Klinik Fase II ini dipisahkan menjadi Fase IIA (untuk menentukan dosis) dan Fase IIB (untuk menentukan khasiat obat).
Fase III
Uji Klinik Fase III melibatkan sekelompok besar pasien (misal 300-3000 orang) yang ditentukan secara random (acak), kemudian diamati efek yang ditimbulkan.