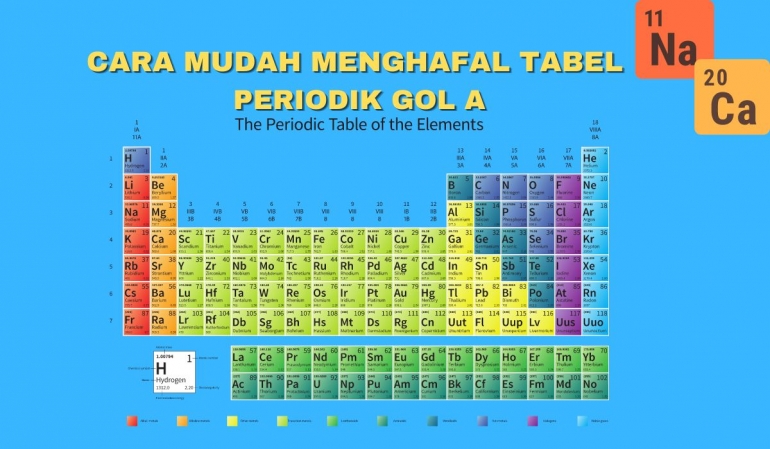
Dalam pelajaran kimia tentuya sudah tidak asing lagi dengan Tabel Periodik yang dimana terdapat unsur-unsur di bumi ini. Tabel peridok berfungsi untuk mengelompokan tiap unsur dan disesuaikan dengan sifat, elektron dan tingkat ionisasi.
masing-masing golongan memiliki jumlah elektron yang berbeda, kecuali golongan VIIIA dimana pada golongan ini jumlah elektron sudah stabil dan biasanya untuk melepas elektron akan sangat sulit.
Pada golongan 1A-VIIA jumlah electron belum stabil dibutuhkan sumbangan electron agar dapat stabil.
Golongan 1A atau logam alkali : H (Hidrogen), Li (Lithium), Na (Natrium), K (Kalium), Rb (Rubinium), Cs (Cesium) dan Fr (Fransium). Untuk mengafalnya bisa dengan "Herlina Kawin Robi Cs Frustasi". Golongan 1A memiliki konfigurasi akhir dengan muatan electron 1 atau biasa disebut dengan kation. Perlu diketahui bahwa H (Hidrogen) bukan termasuk logam, akan tetapi tetap masuk pada golongan 1A.
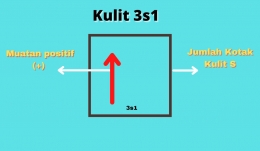
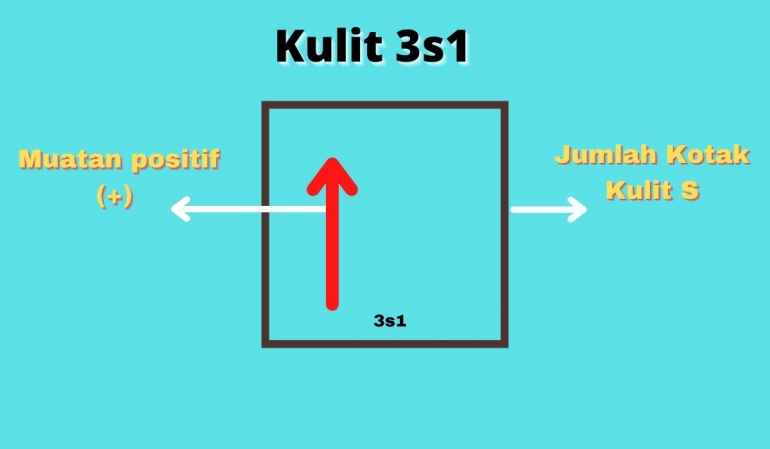
Contoh : Konfigurasi dari 11Na : 1s2 , 2s2 2s6 , 3s1
Bisa dilihat 3s1 memiliki muatan 1. Ini akan menjawab kenapa pada muatan pada golongan 1A bermuatan 1. Karena untuk mecapai kesetabilan harus melepas 1 buah electron agar dapat stabil.
Blok 3s1, menandakan golongan I periode 3.
Golongan IIA atau logam alkali tanah : Be (Berium), Mg (Magnesium), Ca (Calsium), Sr (Stronsium), Ba (Barium) dan Rb (Rubidium). Golongan IIA memiliki akhiranya dengan muatan electron 2. Untuk menghafalnya bisa "Beli Mangga Cari Srikaya Bagi Rambutan".