Dalam kehidupan sehari-hari, senyawa asam dan basa memiliki peranan penting dalam kehidupan sehari-hari. Seperti ditemukan dalam tubuh makhluk hidup, makanan, obat-obatan, produk rumah tangga, pertanian maupun bahan baku industri. Berikut ini adalah gambar-gambar kegunaan asam dan basa yang sering digunakan dalam kehidupan sehari-hari:
Berdasarkan gambar-gambar tersebut, tahukah kalian apa pengertian dari senyawa asam-basa? Bagaimana cara membedakannya? Untuk mengetahuinya, kalian akan mempelajari pada bab ini.
Teori Asam Basa
Istilah asam (acid) berasal dari bahasa Latin "acetum" yang berarti cuka, karena diketahui zat utama dalam cuka adalah asam asetat. Adapun basa (alkali) berasal dari bahasa Arab yang berarti abu. Hingga saat ini, ada tiga pengertian asam-basa yang dikemukakan oleh empat ilmuwan. Mereka adalah Svante Arrhenius, Johannes Bronsted, Thomas Lowry, dan Gilbert Newton Lewis. Namun, pada pembahasan kali, hanya akan dibahas tentang teori asam-basa menurut Svante Arrhenius.
1. Teori Asam Basa Arrhenius
Tahun 1884, ilmuwan Swedia bernama Svante Arrhenius mengemukakan pengertian asam-basa berdasarkan reaksi ionisasi. Menurut Arrhenius, asam adalah zat yang dalam air dapat melepaskan ion hidrogen (H+), sedangkan basa adalah zat yang dalam air dapat melepaskan ion hidroksida (OH-). Hal ini dapat dijelaskan dengan persamaan reaksi ini:
Berdasarkan persamaan reaksi, berikut beberapa contoh dari senyawa asam-basa menurut Arrhenius dan reaksi ionisasinya.
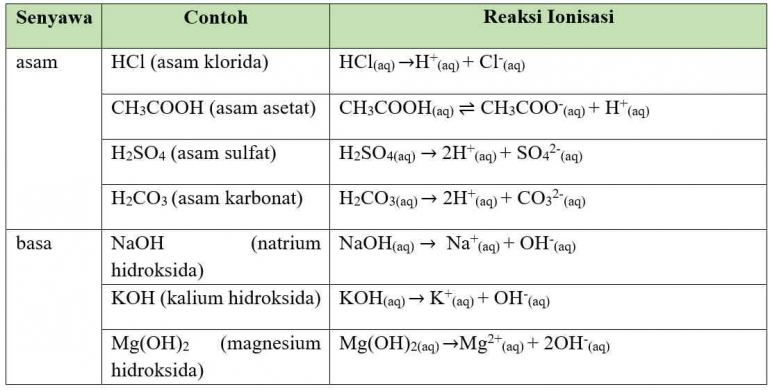
Berdasarkan tabel tersebut, kalian dapat mengetahui bahwa jumlah ion H+ dan OH- yang dihasilkan dalam reaksi ionisasi berbeda-beda, tergantung pada jumlah ion pengikatnya. Berdasarkan jumlah ion H+ (untuk asam) dan OH- (untuk basa) yang dihasilkan oleh reaksi ionisasi, senyawa asam-basa dapat dikelompokkan menjadi asam-basa monoprotik dan poliprotik.
Asam Monoprotik dan Poliprotik















